题目内容
【题目】氯化钠(食盐的主要成分)是日常生活中重要的调味品,具有广泛的应用。
(1)下列有关氯化钠用途的说法,正确的是_____(填字母序号)。
A用食盐水除去水垢
B用食盐水除去铁锈
C用加碘食盐配制生理盐水
D用食盐消除公路上的积雪
(2)某氯化钠样品中混有氯化钙和硫酸镁杂质,为得到较纯的氯化钠,先将样品溶于水,然后进行如下操作:A加过量的 Na2CO3 溶液 B加过量的 Ba(OH)2 溶液 C蒸发 D加适量的盐酸 E过滤。
①以上操作合理的先后顺序为_______________(字母序号不能重复使用)。
②经过滤操作后在滤纸上能得到哪些固体____________?
③加入过量 Na2CO3 溶液的目的是____________?
(3)利用“酸碱中和反应”也可以得到氯化钠。某实验小组同学将盐酸逐滴滴入一定量的 氢氧化钠溶液中,得到 pH 的变化如图所示。
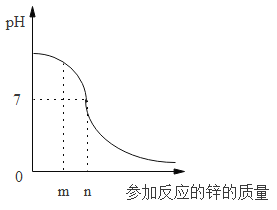
①简述使用 pH 试纸测定溶液酸碱度的操作_____________。
②当加入 m g 盐酸时,溶液中的溶质有_____________(填化学式)。
③若改用 n g 相同质量分数的稀硫酸与相同量的氢氧化钠溶液反应,充分反应后,向其中滴加石蕊溶液,溶液变 为______________(填“红色”、“蓝色”或“无色”)。
(4)氯碱工业常用电解饱和食盐水的方法来得到烧碱和两种气体,一种是最轻的气体,另一种气体的相对分子质量为 71。要制取 80 t 纯净的烧碱,理论上需要含杂质 10%的 粗盐_______________吨?
【答案】D BAEDC CaCO3、BaCO3、BaSO4、Mg(OH)2 除尽CaCl2杂质和过量的Ba(OH)2 用玻璃棒蘸取少量待测溶液,滴到pH试纸上,将显色的颜色与标准比色卡比对,读数 NaCl、NaOH 蓝色 130
【解析】
(1)A、氯化钠不能与水垢反应。A错误;
B、氯化钠不能与铁锈反应。B错误;
C、加碘食盐中含有碘元素,不能用于配制生理盐水。C错误;
D、氯化钠溶于水形成溶液后溶液的凝固点降低,所以氯化钠可以帮助消除公路上的积雪。D正确。
故答案为:D;
(2)①要除去粗盐中含有的杂质,可以加过量的氢氧化钡溶液除去硫酸镁,加过量的Na2CO3溶液除去氯化钙和过量试剂氢氧化钡,通过过滤把不溶于水的物质除去,加适量的盐酸除去过量的碳酸钠,最后蒸发结晶得到氯化钠晶体并除去盐酸。故答案为:BAEDC;
②通过分析可知,滤纸上得到的固体是难溶于水的固体,则滤纸上得到的固体是氢氧化镁、硫酸钡、碳酸钙、碳酸钡。故答案为:CaCO3、BaCO3、BaSO4、Mg(OH)2;
③加过量的Na2CO3溶液,碳酸钠和氯化钙和氢氧化钡会反应,则加入的目的是除去氯化钙和过量试剂氢氧化钡。故答案为:除尽CaCl2杂质和过量的Ba(OH)2;
(3)①用pH试纸测定未知溶液的pH时,正确的操作方法为:取一片pH试纸放在玻璃片或白瓷板上,用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH。故答案为:用玻璃棒蘸取少量待测溶液,滴到pH试纸上,将显色的颜色与标准比色卡比对,读数;
②盐酸与氢氧化钠反应生成氯化钠和水。当加入mg盐酸时,溶液的pH>7,显碱性,所以溶液中的溶质有氯化钠和氢氧化钠。故答案为:NaCl、NaOH;
③盐酸和氢氧化钠反应生成氯化钠和水,方程式为:HCl+NaOH=NaCl+H2O。硫酸和氢氧化钠会反应生成硫酸钠和水,方程式为:H2SO4+2NaOH=Na2SO4+2H2O。通过方程式可知,每73份质量的盐酸会中和80份质量的氢氧化钠,每98份质量的硫酸会中和80份质量的氢氧化钠。所以改用ng与盐酸质量分数相同的稀硫酸来与相同量的氢氧化钠溶液反应,氢氧化钠有剩余,所得溶液的pH大于7,溶液显碱性,向其中滴加石蕊溶液,溶液变为蓝色。故答案为:蓝色;
③设理论上需要含杂质10%的粗盐的质量为x。
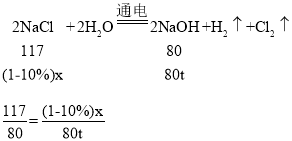
解得x=130t。
所以理论上需要含杂质10%的粗盐130t。

 阅读快车系列答案
阅读快车系列答案【题目】在老师的指导下,小乐同学探究金属和盐溶液反应时,发现将钠放入MgCl2溶液中有气泡和白色沉淀产生。为了进一步探究,小乐同学将充分反应后的混合物过滤,得固体A和滤液B。
(查阅资料)①钠与水反应生成氢氧化钠和氢气。②2NaOH+ MgCl2= 2NaCl +Mg(OH)2↓。③MgCl2溶液呈酸性。
(分析思考)
小乐同学根据所学知识对产生的气体和固体A进行判断:
(1)产生的气体是____(填序号)。①CO2 ②H2 ③Cl2
(2)取A加入过量稀盐酸中,A全部溶解,无气泡产生,则A的名称是____。
(提出问题)滤液B中溶质的成分是什么?
猜想一:NaCl 猜想二:NaCl、MgCl2
猜想三:NaCl、NaOH 猜想四:NaCl、MgCl2、NaOH
小乐同学认为猜想____不成立,理由是____。
(实验探究)
实验操作 | 实验现象 | 实验结论 |
步骤一:取少量滤液B于试管中,滴加几滴无色酚酞,振荡,观察现象 | 溶液__ | 猜想三不成立 |
步骤二:取少量滤液B于试管中,滴加适量 NaOH溶液,振荡,观察现象 | 产生白色沉淀 | 猜想_____成立 |
(实验结论)在金属活动性顺序里,钠不能将位于它后面的金属从该金属的盐溶液中置换出来。
(拓展延伸)将钠与MgCl2固体隔绝空气加热到一定温度时,钠可以从氯化镁中置换出镁,该反应的化学方程式是____。
【题目】在做“铁在氧气里燃烧”实验时,小红等同学进行了以下探究活动,请你一同参与。
(1)实验时要用砂纸擦去铁丝表面的铁锈,这个过程属于________变化。
(2)小明同学实验时,瓶底放了少量水,但集气瓶仍炸裂了,请你帮助他分析一下可能的原因________。
(3)探究直径为0.38mm的铁丝燃烧是否需要纯氧
(实验内容)取0.38mm的铁丝,分别在体积分数为90%、70%、65%、60%、55%的氧气中进行实验,实验现象如下表所示:
O2的体积分数 | 90% | 70% | 65% | 60% | 55% |
实验现象 | 燃烧剧烈、燃烧时间长,效果好 | 燃烧比90%弱,燃烧时间短,实验成功 | 燃烧比70%弱,燃烧时间比70%短,实验成功 | 燃烧比65%弱,燃烧时间更短,实验成功 | 难以燃烧,只是发红 |
(实验结论):就0.38mm铁丝而言,燃烧所需氧气的最低体积分数为60%,且氧气浓度越大,燃烧现象越________。(填“剧烈”或“不剧烈”);
(实验拓展):(4)上述关于铁丝燃烧所需氧气最低浓度的结论是否合理,请说出理由?
________(填 “合理”或 “不合理”),理由:________。
(5)小红对小明的实验进行了改进,并对铁丝在氧气中燃烧时“火星四射”的现象与其含碳量的关系进行了如下探究。
实验操作 | 实验现象 | 解释与结论 |
实验①:取直径0.20mm,含碳0.1%的铁丝,在氧气中燃烧 | 零星的 火星 | ①写出铁燃烧的文字或符号表达式:____; ②铁丝在氧气中燃烧,“火星四射”与其含碳量的关系为________。 |
实验②:取直径0.20mm,含碳0.32%的铁丝,在氧气中燃烧 | 较明显的 火星四射 |
【题目】根据下列溶解度曲线和A物质的部分温度是的溶解度判断下列说法正确的是( )
温度/℃ | 0 | 20 | 40 | 60 | |
溶解度/g | A物质 | 20 | 28 | 45 | 60 |

A. 由上图可知,KNO3和NaCl的溶解度均大于A 物质的溶解度
B. 10℃时,将40gNaCl放入50g水中,充分溶解,所得溶液是NaCl的不饱和溶液
C. 将30℃时NaCl、KNO3、和A物质的饱和溶液各降温至10℃,所得溶液的溶质质量分数大小为:KNO3>NaCl>A
D. 20℃时,将KNO3、NaCl和A物质各30g分别配制成恰好饱和溶液,所得溶液的质量大小为A>KNO3=NaCl
【题目】某学校化学活动小组的同学对碳酸钠与稀盐酸的反应进行了下列探究:
[探究一]向放有一支燃着的蜡烛的烧杯中加适量碳酸钠和稀盐酸(如图1所示):
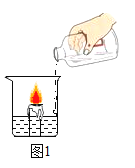
(1)烧杯中看到的现象是:______________,说明二氧化碳具有的化学性质是:___________ 。
(2)碳酸钠与稀盐酸反应产生的气体具有的另一个用途是____________ 。
[探究二]碳酸钠与稀盐酸反应后剩余溶液的成分探究(假设二氧化碳已完全放出,杂质溶于水,不参加反应且呈中性)。甲、乙两同学分析认为剩余溶液中一定含有氯化钠,可能有盐酸或碳酸钠。为验证是否含有盐酸,他们采用了不同方法进行实验,得到了相同的结论。
查找资料:氯化钠溶液呈中性
实验操作 | 实验现象 | 结论 | |
甲 | 取样于试管中,滴加__________试液 | 试液变红 | 有盐酸 |
乙 | 取样于试管中,逐滴滴加碳酸钠溶液 | ______________ |
[探究三]测定所用稀盐酸的溶质质量分数?[实验原理]通过测定足量碳酸钠样品与一定质量的稀盐酸反应生成二氧化碳的体积来计算稀盐酸的溶质质量分数。
[实验设计]小伍称取一定质量的样品,按如图2装置进行实验(已知该装置气密性良好,水准管高度可以上下调节,量气管是带有刻度的仪器)。
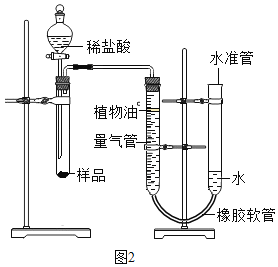
[反思与评价](1)在实验中,若没有植物油,测定结果会________(填“偏大”、“偏小”或“不变”)。
(2)操作中,下列情况不影响测定结果的是___________(填字母).
A实验前试管中有空气 B实验中水准管口有水溢出
C读数时量气管和水准管液面不相平 D实验后生成的气体在试管中仍有滞留