��Ŀ����
����Ŀ����ͼ��A-I��ʾ���ֳ��л�ѧ���������ʣ�����A��D��I�������I����Ԫ��������Ϊ3:4��BԪ���ڵؿ��к���λ�ӵ�����C������Ԫ����ɣ�GΪ�Ϻ�ɫ��HΪ��ɫ���嵥�ʡ���ͼ�в��ַ�Ӧ��������Ӧ��������ȥ��
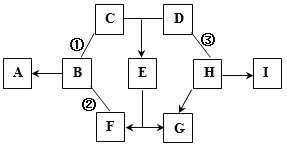
��1��д����ѧʽ��G_____�� E_____��
��2��д����ѧ����ʽB��A��_____________________________��
��3����Ӧ�٢ڢ۵Ļ���������ͬ����_______��
��4��д��H��D��Ӧ�Ļ�ѧ����ʽ_______________�����ֳ�D���ʾ���______�ԡ�
���𰸡� Cu CuSO4 4Al + 3O2 == 2Al2O3 �û���Ӧ C + 2CuO ![]() 2Cu + CO2�� ������
2Cu + CO2�� ������
���������ؿ���Ԫ�غ�������ǰ��λ���ǣ�O��Si��Al��Fe ��BԪ���ڵؿ��к���λ�ӵ�������ôB������GΪ�Ϻ�ɫ����ôG��ͭ������B������A�����������ת��ΪA����A����������4Al + 3O2 == 2Al2O3�� I�������I����Ԫ��������Ϊ3:4����֪I��һ����̼����ɫ�ĵ��ʺ����ۺ�̼�ۣ�HΪ��ɫ���嵥�ʣ����ܷ�Ӧ����һ����̼����H��̼������ת����ϵ��̼����������D��Ӧ����ôD�ǽ����������������������뻹ԭ�����ʷ�Ӧ�⣬�������ᷴӦ������C������Ԫ����ɣ���C��ϡ���ϡ������D��Ӧ����E��E��ת��Ϊͭ����E������ͭ����ôD������ͭ������ͭת��Ϊͭ���������û���Ӧ��ͬʱ��������F��F��������Ӧ����F�������������������ƶϳ������ʴ���ת����ϵ�У��ƶ���ȷ����1��G��ͭ��Cu��E������ͭ��CuSO4����2��B������A��������������������Ӧ������������4Al + 3O2 == 2Al2O3����3����Ӧ�����������ᷴӦ��������������������Ӧ������������������Ӧ������������������Ӧ����̼������ͭ��Ӧ����ͭ�Ͷ�����̼�������ַ�Ӧ����һ�ֵ��ʺ�һ�ֻ����ﷴӦ������һ�ֵ��ʺ���һ�ֻ�������û���Ӧ����4���ڸ��������£�̼��ԭ����ͭ����ͭ�Ͷ�����̼��C + 2CuO ![]() 2Cu + CO2��������ͭ�е�����̼��ȥ�����л�ԭ�ԡ�
2Cu + CO2��������ͭ�е�����̼��ȥ�����л�ԭ�ԡ�

����Ŀ������ͼ����ʵ�飬ͬʱ����Ͳ��ȫ��Һ��Ѹ��ע�������У�ʵ���������±���ʾ��ʵ�鿪ʼǰ��īˮ��������Һ�汣����ƽ�������������ͬ��װ�����������á�

ʵ���� | ������ | ��Ͳ�� | ������ | ��Ͳ�� | ��īˮҺ��λ�� |
a | ������̼ �������� | 10mL����ʯ��ˮ | ������̼ �������� | V mLˮ | ��������ҵ� |
b | 0.5gп�� | 15mL20%��ϡ���� | 0.5g���� | 15mL20%��ϡ���� |
��1��ʵ��a�У��������ڲ�����������_______________����Ͳ����ˮ�����V= ________ mL����īˮҺ��λ�÷����仯��ԭ����________________________���û�ѧ����ʽ��ʾ����
��2��ʵ��b�У���Ͳ����������������������������ͬ���������ݽϾ��ҵ�������________������� ��īˮҺ��λ�õı仯�����________������ĸ��ţ���
A����ʼ����ҵͣ���������Ҹ� B����ʼ����Ҹߣ���������ҵ�
���ָñ仯��ԭ��ʼ____________________________________________��
����___________________________________________________��