题目内容
【题目】将等质量的锌粉和铁粉分别放入足量的等浓度等体积的稀硫酸中,生成氢气的质量与反应时间的关系如图所示,下列说法一定正确的是( ) 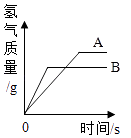
A.金属活动性A>B
B.A是铁粉,B是锌粉
C.反应消耗的稀硫酸质量A=B
D.产生氢气质量A=B
【答案】B
【解析】解:A、B和稀硫酸反应的时间比A和稀硫酸反应的时间短,说明金属活动性B>A,该选项说法不正确; B、锌、铁和稀硫酸反应的化学方程式及其质量关系为:
Zn+H2SO4═ZnSO4+ | H2↑, | Fe+H2SO4═FeSO4+ | H2↑ |
65 | 2 | 56 | 2 |
由以上关系可知,等质量的锌粉和铁粉分别放入足量的等浓度等体积的稀硫酸中,完全反应后铁和稀硫酸反应生成的氢气多,并且锌和稀硫酸反应的速率比铁和稀硫酸反应的速率快,因此A是铁粉,B是锌粉,该选项说法正确;
C、因为反应生成的氢气中的氢元素完全来自于硫酸,因此生成的氢气质量不同时消耗的硫酸质量也不同,该选项说法不正确;
D、由图中可知,产生氢气质量是A>B,该选项说法不正确.
故选:B.
【考点精析】通过灵活运用金属材料的选择依据,掌握黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属即可以解答此题.

练习册系列答案
 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案 互动课堂系列答案
互动课堂系列答案
相关题目