题目内容
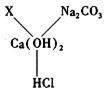
(6分)现欲探究一固体混合物A的成分,已知其中可能含有NaCl、NH4NO3、MgSO4、Cu(OH)2、NaOH、CaCO3六种物质中的两种或多种。按下图所示进行实验,出现的现象如图中所述(设过程中所有发生的反应都恰好完全反应)。

试推断:
(1)现象X为: 。
(2)白色沉淀E为 (写化学式)。
(3)无色滤液F中含有的阴离子为 (写离子符号)。
(4)请写出一个过程④发生反应的化学方程式 。
(5)固体混合物A中一定含有的物质为: ,可能含有 。

试推断:
(1)现象X为: 。
(2)白色沉淀E为 (写化学式)。
(3)无色滤液F中含有的阴离子为 (写离子符号)。
(4)请写出一个过程④发生反应的化学方程式 。
(5)固体混合物A中一定含有的物质为: ,可能含有 。
(6分)变蓝; BaSO4; Cl-;
CaCO3+2HCl==CaCl2=H2O+CO2↑ 或Mg(OH)2+2HCl==MgCl2+2H2O;
NH4NO3,NaOH,CaCO3,MgSO4; NaCl 。
CaCO3+2HCl==CaCl2=H2O+CO2↑ 或Mg(OH)2+2HCl==MgCl2+2H2O;
NH4NO3,NaOH,CaCO3,MgSO4; NaCl 。
固体A加水后产生了气体,说明固体中含有氢氧化钠和硝酸铵,氢氧化钠溶于水放热,使硝酸铵分解,产生氨气,氨气溶于水显碱性,所以通入紫色石蕊试液,会变蓝;无色滤液中加入硝酸钡,产生白色沉淀说明溶液C中含有硫酸镁,沉淀D加入盐酸后产生无色溶液,说明原固体中不可能有氢氧化铜,因为有的话,F溶液会显蓝色,那沉淀D就只能有碳酸钙了,也就说明原固体中一定含有碳酸钙,整个现象中不能说明是否含有氯化钠,综上所述,原固体中一定含有NH4NO3,NaOH,CaCO3,MgSO4,可能含有NaCl,一定没有Cu(OH)2。

练习册系列答案
相关题目
 ”表示相连的物质之间可以发生反应,“
”表示相连的物质之间可以发生反应,“ ”表示由某一物质可制得另一物质。
”表示由某一物质可制得另一物质。
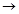 乙的基本反应类型_______________。Y
乙的基本反应类型_______________。Y