题目内容
若取质量均为mg的镁和铁,分别投入到50g溶质质量分数相同的硫酸中,充分反应后,均产生0.2g氢气.请分析推断和计算:
(1)充分反应后,一定有剩余的金属是
(2)硫酸中H2SO4的质量分数.(相对原子质量:H-1、O-16、S-32、Mg-24、Fe-56)
(1)充分反应后,一定有剩余的金属是
镁
镁
,m的取值范围为m≥5.6
m≥5.6
;(2)硫酸中H2SO4的质量分数.(相对原子质量:H-1、O-16、S-32、Mg-24、Fe-56)
分析:等质量铁和镁与足量的稀硫酸反应,镁放出氢气的质量大于铁,而题设中产生氢气量均为0.2g,可推断出稀硫酸量不足而被完全反应,而金属镁一定有剩余;假设铁与硫酸恰好完全反应,根据生成氢气的质量可计算出金属质量m的最小值及参加反应的硫酸的质量,然后计算该稀硫酸中溶质的质量分数.
解答:解:根据反应的化学方程式:
Fe+H2SO4═FeSO4+H2↑ Mg+H2SO4═MgSO4+H2↑
56 2 24 2
5.6g 0.2g 2.4g 0.2g
故可得知,等质量铁和镁与足量的稀硫酸反应,镁放出氢气的质量大于铁;
根据题中信息可以知道等质量的铁和镁,产生等质量的氢气,故可判断金属镁一定有剩余、铁可能有剩余或恰好完全反应;
产生0.2g氢气可计算至少需要5.6g铁,即m的值等于5.6g时铁无剩余,大于5.6g时有剩余;即m的值大于等于5.6g,
(2)根据(1)中的解答可以知道,稀硫酸的量不足,
设生成0.2g氢气需要硫酸的质量为x
Fe+H2SO4═FeSO4+H2↑
98 2
x 0.2g
=
解得:x=9.8g
所以稀硫酸中溶质的质量分数=
×100%=19.6%;
答:硫酸中H2SO4的质量分数为19.6%.
故答案为:(1)镁;m≥5.6;
(2)19.6%.
Fe+H2SO4═FeSO4+H2↑ Mg+H2SO4═MgSO4+H2↑
56 2 24 2
5.6g 0.2g 2.4g 0.2g
故可得知,等质量铁和镁与足量的稀硫酸反应,镁放出氢气的质量大于铁;
根据题中信息可以知道等质量的铁和镁,产生等质量的氢气,故可判断金属镁一定有剩余、铁可能有剩余或恰好完全反应;
产生0.2g氢气可计算至少需要5.6g铁,即m的值等于5.6g时铁无剩余,大于5.6g时有剩余;即m的值大于等于5.6g,
(2)根据(1)中的解答可以知道,稀硫酸的量不足,
设生成0.2g氢气需要硫酸的质量为x
Fe+H2SO4═FeSO4+H2↑
98 2
x 0.2g
| 98 |
| x |
| 2 |
| 0.2g |
解得:x=9.8g
所以稀硫酸中溶质的质量分数=
| 9.8g |
| 50g |
答:硫酸中H2SO4的质量分数为19.6%.
故答案为:(1)镁;m≥5.6;
(2)19.6%.
点评:本题考查了金属与酸反应生成的氢气质量的有关计算,完成此题,可以依据已有的知识结合根据化学方程式的计算进行.

练习册系列答案
相关题目
请按要求回答下列问题:

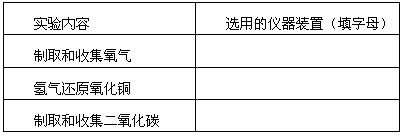
(1)根据下表的实验内容,从上图中选择合适的仪器装置,填入表中。
|
实验内容 |
选用的仪器装置(填字母) |
|
制取和收集氧气 |
|
|
制取和收集氢气 |
|
|
氢气还原氧化铜 |
|
|
制取和收集二氧化碳 |
|
(2)在实验室中,加热氯酸钾和二氧化锰的混合物制取氧气,写出该反应的化学方程式____________________________________;某同学在实验室中,欲从高锰酸钾受热分解后的残渣中回收二氧化锰(已知高锰酸钾、锰酸钾溶于水,二氧化锰难溶于水),正确的实验操作是___________(填序号)。
①溶解、蒸发、结晶 ②溶解、过滤 ③过滤、蒸发、结晶
(3)在氢气还原氧化铜的实验过程中,观察到的现象是_________________________
_____________________________________________________________。
(4)若取质量均为mg的镁和铁,分别投入到50g溶质质量分数相同的硫酸中,充分反应后,均产生0.2g氢气。可推断出:
①充分反应后,一定有剩余的金属是___________。
②m的取值范围为___________,反应中消耗掉金属镁的质量为___________。
③硫酸中H2SO4的质量分数为___________。