��Ŀ����
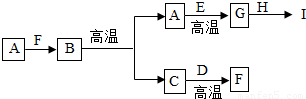
��2010?ɳ����ģ�⣩ȡһ��������ij������̼������Ʒ�����ձ��У�����95.8gˮ����ܽ⣬�������м���ϡ���ᣬ��Ӧ�ų��������������������ϡ�����������ϵ��������ͼ��ʾ����������������⣺��1��������98gϡ����ʱ���ų����������Ϊ______g��
��2�������������ϡ�����������������Ϊ______��������100g����ϡ������20%��������Һ______g��
��3����ͨ�������������98gϡ���ᣨ��A�㣩ʱ�ձ�����Һ���ʵ�������������д��������̣�

���𰸡���������1������ͼʾ���ݣ��ҳ���������98��Ӧ�ĺ��������ֵ��
��2������̼���������ᷴӦ�Ļ�ѧ����ʽ�����ɶ�����̼���������г�����ʽ���Ϳɼ������ȫ��Ӧʱ���뷴Ӧ��H2SO4������Ȼ�������������������ʽ��������������ϡ����������������������ݡ�100g×�������ϡ�����������������÷20%���������������100g����ϡ������20%��������Һ��������
��3����ȫ��Ӧ��A�㣩����Һ�е�����ΪNa2SO4������̼���������ᷴӦ�Ļ�ѧ����ʽ�ɼ������Ӧ����Na2SO4��������Na2CO3��Ʒ�����������������Һ����=Na2CO3��Ʒ����+ˮ������+ϡ��������-���ɶ�����̼��������Ȼ�������������������ʽ���㼴�ɣ�
����⣺��1������ͼʾ���ݿ�֪�����������ϡ����98gʱ����Ӧ����ȫ����Ӧ�ĺ�����ų����������Ϊ4.4g���ʴ�Ϊ��4.4��
��2������ȫ��Ӧʱ���뷴Ӧ��H2SO4����Ϊz��
Na2CO3+H2SO4=Na2SO4+H2O+CO2��
98 44
z 4.4g
��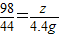 ��
��
��֮�ã�z=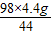 =9.8g��
=9.8g��
���������ϡ�����������������Ϊ�� ×100%=10%��
×100%=10%��
������100g����ϡ������20%��������Һ������Ϊ��100g×10%÷20%=50g��
�ʴ�Ϊ��10%��50��
��3���⣺��ΪX����Ӧ����Na2SO4������Ϊy��
Na2CO3+H2SO4=Na2SO4+H2O+CO2��
106 142 44
X y 4.4g
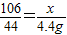 ��
��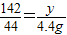 ��
��
��ã�X=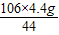 =10.6g��Y=
=10.6g��Y=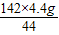 =14.2g��
=14.2g��
�����98gϡ���ᣨ��A�㣩ʱ�ձ�����Һ���ʵ���������Ϊ��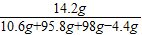 ×100%=7.1%��
×100%=7.1%��
�𣺼���98gϡ���ᣨ��A�㣩ʱ�ձ�����Һ���ʵ���������Ϊ7.1%��
������������Ҫ����ѧ�����û�ѧ����ʽ����������������ʽ��������������Ҫ��ѧ���˽���ȫ��Ӧ�ĸ������ȷ��������ͼ����ͼ���ҳ���Ч���ݽ��м��㣮����ʱҪע���ʽ�Ͳ��裬����Ҫϸ�ģ�
��2������̼���������ᷴӦ�Ļ�ѧ����ʽ�����ɶ�����̼���������г�����ʽ���Ϳɼ������ȫ��Ӧʱ���뷴Ӧ��H2SO4������Ȼ�������������������ʽ��������������ϡ����������������������ݡ�100g×�������ϡ�����������������÷20%���������������100g����ϡ������20%��������Һ��������
��3����ȫ��Ӧ��A�㣩����Һ�е�����ΪNa2SO4������̼���������ᷴӦ�Ļ�ѧ����ʽ�ɼ������Ӧ����Na2SO4��������Na2CO3��Ʒ�����������������Һ����=Na2CO3��Ʒ����+ˮ������+ϡ��������-���ɶ�����̼��������Ȼ�������������������ʽ���㼴�ɣ�
����⣺��1������ͼʾ���ݿ�֪�����������ϡ����98gʱ����Ӧ����ȫ����Ӧ�ĺ�����ų����������Ϊ4.4g���ʴ�Ϊ��4.4��
��2������ȫ��Ӧʱ���뷴Ӧ��H2SO4����Ϊz��
Na2CO3+H2SO4=Na2SO4+H2O+CO2��
98 44
z 4.4g
��
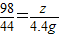 ��
����֮�ã�z=
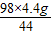 =9.8g��
=9.8g�����������ϡ�����������������Ϊ��
 ×100%=10%��
×100%=10%��������100g����ϡ������20%��������Һ������Ϊ��100g×10%÷20%=50g��
�ʴ�Ϊ��10%��50��
��3���⣺��ΪX����Ӧ����Na2SO4������Ϊy��
Na2CO3+H2SO4=Na2SO4+H2O+CO2��
106 142 44
X y 4.4g
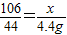 ��
��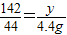 ��
����ã�X=
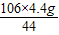 =10.6g��Y=
=10.6g��Y=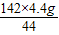 =14.2g��
=14.2g�������98gϡ���ᣨ��A�㣩ʱ�ձ�����Һ���ʵ���������Ϊ��
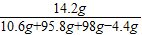 ×100%=7.1%��
×100%=7.1%���𣺼���98gϡ���ᣨ��A�㣩ʱ�ձ�����Һ���ʵ���������Ϊ7.1%��
������������Ҫ����ѧ�����û�ѧ����ʽ����������������ʽ��������������Ҫ��ѧ���˽���ȫ��Ӧ�ĸ������ȷ��������ͼ����ͼ���ҳ���Ч���ݽ��м��㣮����ʱҪע���ʽ�Ͳ��裬����Ҫϸ�ģ�

��ϰ��ϵ�д�
 ��У����ϵ�д�
��У����ϵ�д�
�����Ŀ