题目内容
21、为了验证Zn、Cu、Ag的金属活动性顺序.现实验室提供如下试剂:Cu、Zn、Ag(三种金属片都已打磨好)、ZnCl2溶液、AgNO3溶液、Cu(NO3)2溶液、盐酸、稀硫酸、CuSO4溶液(如有需要,你可另增加别的试剂).
请你设计了一个实验方案进行探究验证:
(1)你认为要达到实验目的,可以选用的试剂组是
(2)实验方案:
请你设计了一个实验方案进行探究验证:
(1)你认为要达到实验目的,可以选用的试剂组是
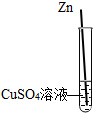
Zn、CuSO4溶液、Ag
.(2)实验方案:
取两支试管装入相同体积和质量分数的CuSO4溶液,然后分别把Zn、Ag投入其中一试管中.观察,Zn表面有红色物质析出,Ag表面无现象.证明三者金属活动性顺序是Zn>Cu>Ag
.分析:主要是依据金属与盐溶液的反应规律以及金属与酸的反应进行分析设计解决.
解答:解:该题的方案很多,主要是利用金属活动性顺序表的应用,涉及到的反应规律有氢前金属可以与酸反应生成氢气,排在前面的金属可以从盐溶液中把排在后面的金属置换出来,该题答案不唯一.
故答案为:Zn、CuSO4溶液、Ag; 取两支试管装入相同体积和质量分数的CuSO4溶液,然后分别把Zn、Ag投入其中一试管中.观察,Zn表面有红色物质析出,Ag表面无现象.证明三者金属活动性顺序是Zn>Cu>Ag
故答案为:Zn、CuSO4溶液、Ag; 取两支试管装入相同体积和质量分数的CuSO4溶液,然后分别把Zn、Ag投入其中一试管中.观察,Zn表面有红色物质析出,Ag表面无现象.证明三者金属活动性顺序是Zn>Cu>Ag
点评:在金属活动性顺序中,越靠前的金属活动性越强,而且只有前面的金属可以把排在它后面的金属从盐溶液中置换出来,根据这一规律来设计解题的思路.

练习册系列答案
相关题目
铜、铁、锌是三种常见的金属,请回答下列问题。
⑴细铁丝在氧气中能发![]() 生燃烧,反应的化学方程式为__ __。
生燃烧,反应的化学方程式为__ __。
⑵铁粉和水蒸气在加热时生成四氧化三铁和氢气,该反应的基本反应类型为__ ![]() __。
__。
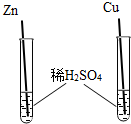
⑶小强同学为了验证Zn、Cu的金属活动性强弱,设计了如下方案,其中能达到实验目的是 (填序号)。
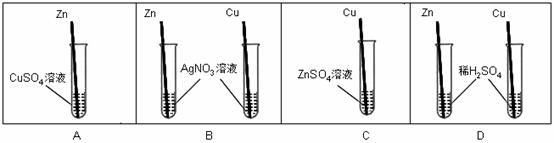 |
⑷向铜粉和铁粉的混合物中加入一定量的盐酸,充分反应后过滤。以下判断正确的是__ __(填序号)。 A B
| A.滤纸上一定没有铜 | B.滤纸上可能含有铁 |
| C.滤液中可能含有盐酸 | D.滤液中一定含有氯化亚铁 |
⑸铜在一定条件下也会生锈。某化学兴趣小组用A~D装置探究铜生锈的条件(A、B、D中均为煮沸过的蒸馏水,B中试管上层充满CO2,C中放有干燥剂,![]() D中通一段时间空气后将试管密封)。
D中通一段时间空气后将试管密封)。
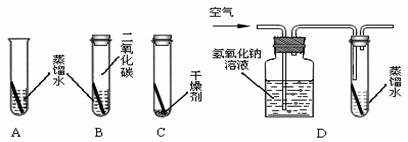
十天后发现,只有A中铜生锈,且水面处铜生锈较严重。
①B中发生反应的化学方程式为__ __。
②铜生锈的条件是__ __。