题目内容
现有NaCl和NaOH的混合物20.0g,加入491.6g一定溶质质量分数的MgCl2溶液与之恰好完全反应,得到滤液500.0g.求:(1)原来固体中NaOH的质量是多少?
(2)所得滤液中溶质质量分数是多少?
【答案】分析:(1)根据质量守恒定律求出氢氧化镁的质量,然后写出化学方程式并计算出氢氧化钠的质量.
(2)根据氢氧化纳的质量求出氯化钠的质量,和生成的氯化钠的质量.然后计算质量分数.
解答:解:设混合物中氢氧化钠的质量为x,反应生成的氯化钠的质量为y,
反应生成氢氧化镁的质量为:20.0g+491.6g-500g=11.6g
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
80 58 117
x 11.6g y
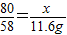
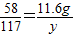
解得,x=16.0g
y=23.4g
答:原来固体中NaOH的质量为16.0g,
(2)滤液中氯化钠的质量为20.0g-16.0g+23.4g=27.4g
滤液中氯化钠质量分数是
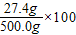 %=5.48%
%=5.48%
答:所得滤液中溶质质量分数是5.48%.
点评:掌握化学方程式的计算格式和规范性,注意滤液中溶液和溶质的质量的计算.
(2)根据氢氧化纳的质量求出氯化钠的质量,和生成的氯化钠的质量.然后计算质量分数.
解答:解:设混合物中氢氧化钠的质量为x,反应生成的氯化钠的质量为y,
反应生成氢氧化镁的质量为:20.0g+491.6g-500g=11.6g
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
80 58 117
x 11.6g y
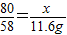
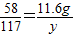
解得,x=16.0g
y=23.4g
答:原来固体中NaOH的质量为16.0g,
(2)滤液中氯化钠的质量为20.0g-16.0g+23.4g=27.4g
滤液中氯化钠质量分数是
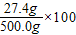 %=5.48%
%=5.48%答:所得滤液中溶质质量分数是5.48%.
点评:掌握化学方程式的计算格式和规范性,注意滤液中溶液和溶质的质量的计算.

练习册系列答案
相关题目