题目内容
【题目】右图是康康同学用蒸馏水、10%氢氧化钠溶液、二氧化碳以及软塑料瓶设计的对比实验,用于证明二氧化碳和氢氧化钠发生反应,实验现象是乙瓶变得更瘪。请回答:
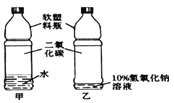
(1)该实验设计不符合对比实验的基本原则,为什么?
(2)设计实验探究反应后乙瓶溶液中溶质的成分。
【答案】(1)两个塑料瓶中液体的体积不同(或两个塑料瓶中二氧化碳的量不同)。(1分)
(2)取乙瓶中溶液,加入足量氯化钙溶液,有沉淀产生,说明存在碳酸钠;往上层清液中滴加酚酞,若溶液变红,则存在氢氧化钠,反之则没有氢氧化钠(或其他合理答案)。
【解析】
试题分析:(1)根据控制变量的方法,可知两个塑料瓶中液体的体积不同(或两个塑料瓶中二氧化碳的量不同)。(2)反应后乙瓶溶液中溶质的成分的探究方案为取乙瓶中溶液,加入足量氯化钙溶液,有沉淀产生,说明存在碳酸钠;往上层清液中滴加酚酞,若溶液变红,则存在氢氧化钠,反之则没有氢氧化钠。

【题目】为探究一瓶敞放的氢氧化钠固体的变质情况,同学们提出了下列猜想:
A只有氢氧化钠固体
B只有碳酸钠固体
C你认为还可能是 固体
①取少量该固体样品置于试管中,向其中加入一种无色溶液,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质。该固体变质的化学方程式 ;则无色溶液可能是 。
②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如下表所示的实验。已知碳酸钠的水溶液呈碱性,它的存在会对氢氧化钠的检验造成干扰。请根据右图部分物质的溶解性表(20℃)所提供的信息,将下表填写完整。

实验目的 | 实验操作 | 现象 | 结论或化学方程式 |
除去碳酸钠 | 取少量该固体样品溶于水配成溶液,滴加适量的 溶液.充分反应后过滤 | 有白色沉淀生成 | 有关反应的化学方程式为 |
检验是否含有氢氧化钠 | 在滤液中滴加酚酞溶液 | 该样品中含有氢氧化钠 |