题目内容
【题目】(6分)过氧化钙(CaO2)难溶于水,常温下稳定,在潮湿空气及水中缓慢放出氧气,广泛应用于渔业等领域。下图是以大理石(含Al2O3及其他不溶于水也不溶于酸的杂质)等为原料制取CaO2的流程图:
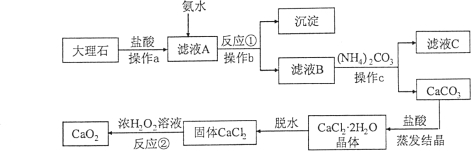
(1)操作a、b、c的名称都是 。
(2)操作a的目的是 。
(3)从滤液C中可回收的副产品的化学式为 。
(4)写出反应①的化学方程式 。
(5)反应②的基本反应类型是 。
【答案】(1)过滤 (2)除去大理石中不溶于水也不溶于酸的杂质 (3)NH4Cl
(4)3NH3·H2O+AlCl3=Al(OH)3+3NH4Cl (5)复分解反应
【解析】
试题分析:(1)操作a、b、c都是将不溶性固体和液体分离,故名称都是:过滤
(2)操作a是加入盐酸,这样大理石中的碳酸钙能与稀盐酸反应生成能溶于水的氯化钙,然后过滤,故目的是:除去大理石中不溶于水也不溶于酸的杂质
(3)滤液B中含有CaCl2溶液,故加入(NH4)2CO3,反应的反应:CaCl2+(NH4)2CO3= 2NH4Cl+CaCO3↓,故经过过滤后,从滤液C中可回收的副产品的化学式为NH4Cl
(4)由于大理石中含有Al2O3,加入盐酸发生反应:Al2O3+6HCl==2AlCl3+3H2O,生成的AlCl3与加入的氨水发生反应①,故化学方程式3NH3·H2O+AlCl3=Al(OH)3↓+3NH4Cl
(5)反应②的化学方程式为:CaCl2+ H2O2=CaO2+2HCl,是两种化合物相互交换成分生成另两种化合物的反应,基本反应类型是:复分解反应

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目