题目内容
【题目】实验小组欲测定双氧水中过氧化氢的物质的量。
【设计原理】将一定质量的双氧水样品与二氧化锰混合,测定反应产生的氧气的质量,再通过方程式计算,得到过氧化氢的量。(“碱石灰”是氧化钙和固体氢氧化钠的混合物,极易吸收水蒸汽)
【过程方法】
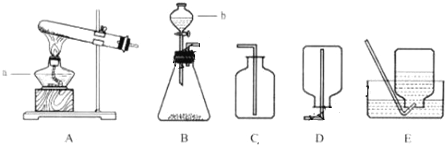
(1)组长首先设计(如图A):向装有样品溶液的锥形瓶中投入二氧化锰,待双氧水完全反应完毕后测得产生氧气的质量是9.6g,则制取氧气为 (13) mol,双氧水中含过氧化氢多少mol?(写出具体计算过程) (14) 。
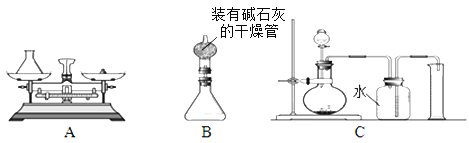
(2)小林对组长的设计提出质疑,在组长方案的锥形瓶上加一装有碱石灰的干燥管(如图B),然后再操 作,请说明小林质疑的理由是 (15) 。
(3)若用C装置来制取氧气并测得氧气的体积,此处的收集方法是 (16) 法,收集到氧气的体积约等于 (17) 。
【答案】0.3 0.6mol 氧气会带走水蒸气;排水集气;流入量筒中液体的体积或量筒中液体的体积
【解析】
试题分析:(1)待双氧水完全反应完毕后测得产生氧气的质量是9.6g,则制取氧气为9.6g÷32g/mol=0.3mol,
设含过氧化氢Xmol
2H2O2![]() 2H2O+O2↑
2H2O+O2↑
2 1
Xmol 0.3mol
2:1=Xmol:0.3mol
X=0.6mol
答:含有过氧化氢的物质的量为0.6mol
(2)氧气会带走水蒸气即制取的氧气不纯净;(3)若用C装置来制取氧气并测得氧气的体积,此处的收集方法是排水集气法,收集到氧气的体积约等于流入量筒中液体的体积或量筒中液体的体积。

【题目】.化学学习让我们有很多收获。下列归纳和总结完全正确的一组是
A.对化学资源的认识 | B.对人物贡献的认识 |
①可用塑料来代替部分铜制造汽车零部件 ②稀土是不可再生的重要战略资源,应合 理利用和保护 | ①拉瓦锡:定量法测定空气的组成 ②张青莲:电解水法测定水的组成 |
C.对物质俗称的认识 | D.对安全的认识 |
①烧碱、纯碱都是氢氧化钠 ②熟石灰、消石灰都是氢氧化钙 | ①点燃可燃性气体前一定要验纯 ②含有亚硝酸钠的工业用盐可以食用 |