题目内容
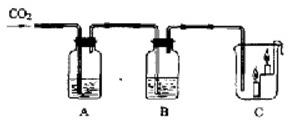
 18、如图所示,A瓶盛有澄清的石灰水,B瓶盛有紫色石蕊试液,C杯有高低不同的燃着的蜡烛.回答下列问题:
18、如图所示,A瓶盛有澄清的石灰水,B瓶盛有紫色石蕊试液,C杯有高低不同的燃着的蜡烛.回答下列问题:(1)A处发生反应的化学方程式
Ca(OH)2+CO2=CaCO3↓+H2O
;(2)B处出现的现象是
紫色石蕊试液变红
;(3)从C处出现的现象中你获得的信息是
二氧化碳的密度比空气大,二氧化碳不能燃烧也不支持燃烧
(填写性质).分析:(1)根据二氧化碳与澄清石灰水(主要成分Ca(OH)2))反应生成碳酸钙沉淀和水写出化学反应式;
(2)从通入的二氧化碳可与水反应生成碳酸,酸可使紫色石蕊试液变色入手分析;
(3)从二氧化碳不能燃烧也不支持燃烧,并且密度大于空气的密度入手分析.
(2)从通入的二氧化碳可与水反应生成碳酸,酸可使紫色石蕊试液变色入手分析;
(3)从二氧化碳不能燃烧也不支持燃烧,并且密度大于空气的密度入手分析.
解答:解:
(1)据题意知A瓶中是澄清的石灰水,澄清石灰水与通入的二氧化碳反应生成碳酸钙沉淀,使澄清的石灰水变浑浊,化学反应式是:Ca(OH)2+CO2=CaCO3↓+H2O.
故答案为:Ca(OH)2+CO2=CaCO3↓+H2O;
(2)据题意知B瓶中是紫色石蕊试液,通入的二氧化碳可与紫色石蕊试液中的水反应生成碳酸,使B瓶中的溶液显酸性.紫色石蕊试液遇酸变红,所以B中的溶液变成红色;
故答案为:紫色石蕊试液变红;
(3)由于二氧化碳的密度大于空气的密度,二氧化碳不燃烧也不支持燃烧.通入的二氧化碳先沉到C杯得底部,使杯中低处燃着的蜡烛先熄灭,高处的蜡烛再熄灭.
故答案为:二氧化碳的密度比空气大,二氧化碳不能燃烧也不支持燃烧.
(1)据题意知A瓶中是澄清的石灰水,澄清石灰水与通入的二氧化碳反应生成碳酸钙沉淀,使澄清的石灰水变浑浊,化学反应式是:Ca(OH)2+CO2=CaCO3↓+H2O.
故答案为:Ca(OH)2+CO2=CaCO3↓+H2O;
(2)据题意知B瓶中是紫色石蕊试液,通入的二氧化碳可与紫色石蕊试液中的水反应生成碳酸,使B瓶中的溶液显酸性.紫色石蕊试液遇酸变红,所以B中的溶液变成红色;
故答案为:紫色石蕊试液变红;
(3)由于二氧化碳的密度大于空气的密度,二氧化碳不燃烧也不支持燃烧.通入的二氧化碳先沉到C杯得底部,使杯中低处燃着的蜡烛先熄灭,高处的蜡烛再熄灭.
故答案为:二氧化碳的密度比空气大,二氧化碳不能燃烧也不支持燃烧.
点评:本题从实验入手,考查二氧化碳的物理和化学性质,切入点巧妙,考查知识点全面.

练习册系列答案
相关题目
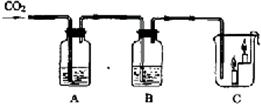
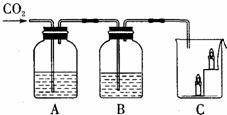 23、如图所示,A瓶盛有澄清的石灰水,B瓶盛有紫色石蕊试液,C杯有高低不同的燃着的蜡烛.回答下列问题:
23、如图所示,A瓶盛有澄清的石灰水,B瓶盛有紫色石蕊试液,C杯有高低不同的燃着的蜡烛.回答下列问题: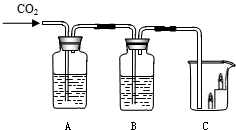 如图所示,A瓶盛有澄清的石灰水,B瓶盛有紫色石蕊试液,C杯有高低不同的燃着的蜡烛.回答下列问题:
如图所示,A瓶盛有澄清的石灰水,B瓶盛有紫色石蕊试液,C杯有高低不同的燃着的蜡烛.回答下列问题: