题目内容
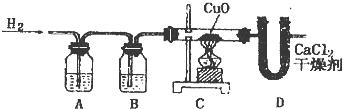
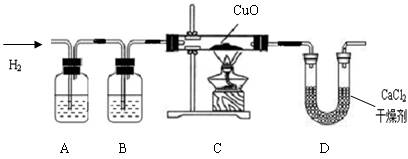
利用纯净、干燥的氢气还原灼热的氧化铜来测定水的组成.实验装置由A、B、C、D、E组成,如图:

请回答下列问题:
①如果某学生用锌和较浓的盐酸制取氢气,他用装置B、C是为了得到纯净、干燥的氢气,他在装置B中通常盛放
②若实验前后,称量结果如下:装氧化铜的玻璃管的质量减少了6.4g,装氯化钙U形管的质量增加了7.2g,根据上述实验数据写出水中氢、氧俩种元素质量比
③在装置E中,将CaCl2改变为

请回答下列问题:
①如果某学生用锌和较浓的盐酸制取氢气,他用装置B、C是为了得到纯净、干燥的氢气,他在装置B中通常盛放
氢氧化钠
氢氧化钠
溶液,为了除去
氯化氢气体
氯化氢气体
;在装置C中盛放的试剂应是
浓硫酸
浓硫酸
,为了除去
水蒸气
水蒸气
.②若实验前后,称量结果如下:装氧化铜的玻璃管的质量减少了6.4g,装氯化钙U形管的质量增加了7.2g,根据上述实验数据写出水中氢、氧俩种元素质量比
1:8
1:8
.③在装置E中,将CaCl2改变为
无水硫酸铜
无水硫酸铜
,才能检验出氢气还原氧化铜有水生成.分析:浓盐酸具有挥发性,能够挥发出氯化氢气体;氢氧化钠溶液能吸收氯化氢气体,浓硫酸能吸收水蒸气;无水硫酸铜吸收水后变成蓝色的硫酸铜晶体;根据有关数据可以求出水中氢、氧俩种元素质量比的原始计算式.
解答:解:①氢氧化钠溶液可以除去氯化氢气体,浓硫酸可以除去水蒸气.
故填:氢氧化钠;氯化氢;浓硫酸;水蒸气.
②装氧化铜的玻璃管的质量减少了6.4g,说明有6.4g氧元素转化成了水中的氧元素,装氯化钙U形管的质量增加了7.2g,说明反应生成了7.2g水,则7.2g水中氢元素的质量为:7.2g-6.4g=0.8g,则水中氢元素和氧元素的质量比是:0.8g:6.4g=1:8.
故填:1:8.
③无水硫酸铜吸收水后变成蓝色的硫酸铜晶体.故填:无水硫酸铜.
故填:氢氧化钠;氯化氢;浓硫酸;水蒸气.
②装氧化铜的玻璃管的质量减少了6.4g,说明有6.4g氧元素转化成了水中的氧元素,装氯化钙U形管的质量增加了7.2g,说明反应生成了7.2g水,则7.2g水中氢元素的质量为:7.2g-6.4g=0.8g,则水中氢元素和氧元素的质量比是:0.8g:6.4g=1:8.
故填:1:8.
③无水硫酸铜吸收水后变成蓝色的硫酸铜晶体.故填:无水硫酸铜.
点评:解答本题要掌握各种物质的性质和相关方面的计算方法,只有这样才能对相关方面的问题做出正确的判断.

练习册系列答案
相关题目