题目内容
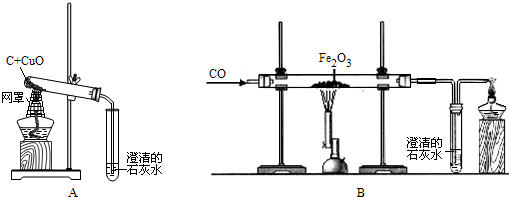
 物质的性质决定着物质的在生产和生活中的用途.木炭和一氧化碳都具有还原性,可用于冶炼金属.请根据下图回答.
物质的性质决定着物质的在生产和生活中的用途.木炭和一氧化碳都具有还原性,可用于冶炼金属.请根据下图回答.(1)请写出下列反应的化学方程式:
①澄清石灰水变浑浊:
Ca(OH)2+CO2=CaCO3↓+H2O
Ca(OH)2+CO2=CaCO3↓+H2O
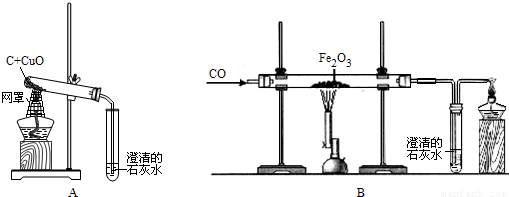
②一氧化碳还原氧化铁:
3CO+Fe2O3
2Fe+3CO2
| ||
3CO+Fe2O3
2Fe+3CO2
| ||
(2)装置中点燃尾气的作用是:
除去未反应完的一氧化碳气体,防止污染空气
除去未反应完的一氧化碳气体,防止污染空气
(3)先通一会CO再加热的原因是:
排净试管内的原有空气,防止爆炸
排净试管内的原有空气,防止爆炸
(4)当观察到
红色固体全部变为黑色
红色固体全部变为黑色
现象时,证明氧化铁粉末已经完全反应.分析:(1)运用木炭和一氧化碳的还原性和化学方程式的书写解答.
(2)运用一氧化碳的特性解答.
(3)运用一氧化碳还原氧化铁的实验步骤和一氧化碳的性质解答.
(4)通过观察生成气体的情况判断碳和氧化铜的反应情况.
(2)运用一氧化碳的特性解答.
(3)运用一氧化碳还原氧化铁的实验步骤和一氧化碳的性质解答.
(4)通过观察生成气体的情况判断碳和氧化铜的反应情况.
解答:解:(1)①二氧化碳与氢氧化钙溶液反应,则Ca(OH)2+CO2=CaCO3↓+H2O;②一氧化碳和氧化铁反应生成铁和二氧化碳,故②答案:3CO+Fe2O3
2Fe+3CO2
(2)一氧化碳具有可燃性燃烧生成二氧化碳,并且一氧化碳具有毒性不能直接排放,故可用点燃的方法处理,故答案:除去未反应完的一氧化碳气体,防止污染空气;
(3)一氧化碳具有可燃性,必须注意纯度;先通一会CO再加热的原因是排净试管内的原有空气,防止爆炸;
(4)当观察到 红色固体全部变为黑色现象时,证明氧化铁粉末已经完全反应.
故答案为:(1)①Ca(OH)2+CO2=CaCO3↓+H2O;②3CO+Fe2O3
2Fe+3CO2
(2)除去未反应完的一氧化碳气体,防止污染空气;
(3)排净试管内的原有空气,防止爆炸;
(4)红色固体全部变为黑色.
| ||
(2)一氧化碳具有可燃性燃烧生成二氧化碳,并且一氧化碳具有毒性不能直接排放,故可用点燃的方法处理,故答案:除去未反应完的一氧化碳气体,防止污染空气;
(3)一氧化碳具有可燃性,必须注意纯度;先通一会CO再加热的原因是排净试管内的原有空气,防止爆炸;
(4)当观察到 红色固体全部变为黑色现象时,证明氧化铁粉末已经完全反应.
故答案为:(1)①Ca(OH)2+CO2=CaCO3↓+H2O;②3CO+Fe2O3
| ||
(2)除去未反应完的一氧化碳气体,防止污染空气;
(3)排净试管内的原有空气,防止爆炸;
(4)红色固体全部变为黑色.
点评:学会运用反应原理和反应中物质的状态和性质去分析实验中的操作方案是解答这类题目的关键.

练习册系列答案
相关题目