题目内容
【题目】根据如图所示装置回答下列有关问题:
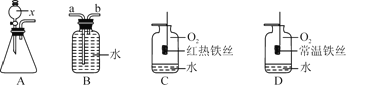
(1)仪器x的名称是____。
(2)若用装置B收集氧气,进气口应为__(填“a”或“b”)端。
(3)对比装置C和D,可以得出关于可燃物燃烧的条件是____。
(4)装置C中反应的化学方程式是_____________________
(5)在做硫燃烧时集气瓶中装入少量水的目的是__________________
【答案】长颈漏斗b温度要达到可燃物的着火点3Fe+2O2![]() Fe3O4吸收二氧化硫,防止污染空气
Fe3O4吸收二氧化硫,防止污染空气
【解析】
(1)据图可知仪器x的名称是长颈漏斗;
(2)氧气不易溶于水且密度比水小,用装置B收集氧气,应从b进入;
(3)C中红热的铁丝能燃烧,D中常温下的铁丝不燃烧,可以得出可燃物燃烧必须达到着火点;
(4)铁在氧气中燃烧生成四氧化三铁,C中反应的化学方程式是:3Fe+2O2![]() Fe3O4 ;
Fe3O4 ;
(5)硫和氧气在点燃的条件下生成二氧化硫,二氧化硫会污染空气,集气瓶内预先加有少量水,它的目的是:吸收二氧化硫,防止污染空气。

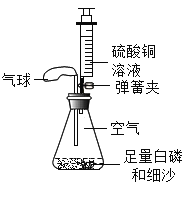
【题目】小明、小强和小峰在学习了“质量守恒定律”后来到化学实验室亲自进行了实验探究,如图是他们分别设计的实验,请你与他们一起进行探究,并回答问题.

实验1:称量镁条,点燃,待反应结束后,再称量.
实验2:将盛有稀盐酸的小试管放入盛有锌粒的烧杯中称量,然后使稀盐酸与锌粒接触,充分反应后再称量.
实验3:将盛有氢氧化钠溶液的小试管放入盛有硫酸铜溶液的锥形瓶中称量,然后使氢氧化钠溶液与硫酸铜溶液混合,充分反应后再称量.
数据见下表:(锌与盐酸反应:Zn+2HCl=ZnCl2+H2↑;氢氧化钠溶液与硫酸铜溶液反应:CuSO4+2NaOH═Cu(OH)2↓+Na2SO4)
编号 | 实验1 | 实验2 | 实验3 |
反应前称量质量 | 9.6g | 212.6g | 118.4g |
反应后称量质量 | 16.0g | 212.4g | 118.4g |
(1)写出实验1反应的化学方程式_____.
(2)上述三个反应_____(填“符合”或“不符合”)质量守恒定律,实验_____正确反映了反应物与生成物的质量关系.
(3)由上述实验我们得到启示,探究_____的反应验证质量守恒定律,实验必须在密闭的装置中进行.
(4)由质量守恒定律可知,化学反应前后,一定不变的是_____(填序号).
①物质种类②元素种类③原子种类④分子种类⑤分子数目⑥原子数目.