题目内容
【题目】某同学在实验室用氯酸钾和二氧化锰的混合物26克制取氧气。加热至混合物固体质量不再减少为止,冷却后称得剩余固体质量为16.4克。
(1)生成氧气的质量是多少克?
(2)求反应前混合物中氯酸钾的质量分数?
【答案】
(1)9.6g
(2)解:设氯酸钾的质量为x
2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
245 96
x 9.6g
245:96=x:9.6g
x=24.5g
反应前混合物中氯酸钾的质量分数=![]() =94.2%
=94.2%
答:反应前混合物中氯酸钾的质量分数为94.2%。
【解析】生成氧气的质量=26g-16.4g=9.6g
【考点精析】通过灵活运用质量守恒定律及其应用和根据化学反应方程式的计算,掌握①质量守恒定律只适用于化学变化,不适用于物理变化;②不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中;③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏;各物质间质量比=系数×相对分子质量之比即可以解答此题.

 阅读快车系列答案
阅读快车系列答案【题目】某同学用镁条测定空气中氧气含量,实验完毕,冷却后进入水的体积远大于总容积的1/5,且产生了淡黄色固体。某兴趣小组对此现象作如下探究。 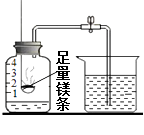 【问题】为什么会生成淡黄色固体?为什么测得氧气的体积分数会明显偏大? 【资料】镁元素化合物的颜色:
【问题】为什么会生成淡黄色固体?为什么测得氧气的体积分数会明显偏大? 【资料】镁元素化合物的颜色:
物质 | MgO | MgCl2 | Mg3N2 | Mg(NO3)2 | MgCO3 | Mg(OH)2 |
颜色 | 白色 | 白色 | 淡黄色 | 白色 | 白色 | 白色 |
(1)【猜想】
小组成员一致认为产物中一定不含有氯化镁,理由是;
(2)分析资料,小组成员认为淡黄色固体是Mg3N2 , 是由镁与空气中的(填化学式)反应生成的,导致进入水的体积远大于总容积的1/5。
(3)【实验】小组成员设计并进行了下列实验。 ①组装仪器(如下图,钟罩下端无底)。 ②将足量白磷在空气中点燃后,迅速伸入钟罩内,塞紧橡皮塞(图1); 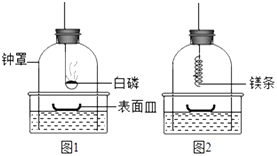 ③待钟罩内水面不再变化时,向水槽中加水,使水槽中液面与钟罩内液面相平; ④打开橡皮塞,将燃着的螺旋状镁条迅速伸入钟罩内,塞紧橡皮塞(图2); ⑤待钟罩内水面不再变化时,观察钟罩内壁及表面皿中出现淡黄色固体。
③待钟罩内水面不再变化时,向水槽中加水,使水槽中液面与钟罩内液面相平; ④打开橡皮塞,将燃着的螺旋状镁条迅速伸入钟罩内,塞紧橡皮塞(图2); ⑤待钟罩内水面不再变化时,观察钟罩内壁及表面皿中出现淡黄色固体。
【分析】
请将步骤①补充完整。
(4)步骤②中将足量白磷在钟罩内燃烧的目的是;钟罩内水面的变化情况是。
(5)步骤③中加水的目的是为了防止。 【结论】小组同学的猜想正确。
(6)【拓展】通过以上探究,你对燃烧有什么新认识?请写一点。

