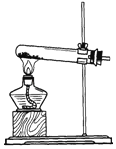
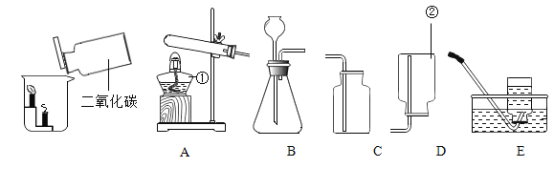
题目内容
【题目】如图是初中化学中常见的实验。
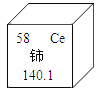
(1)A中现象:烧杯②中溶液变红。请用分子的知识解释“变红”的原因______;
(2)B、C两实验中集气瓶底部有少量水,其作用是______________;燃烧过程中,火焰颜色不同的原因是___________;
(3)D实验完毕,集气瓶内水面上升到一定高度后,不能继续上升,这种现象说明氮气具有______________的性质;若从烧杯中进入集气瓶内水的体积明显小于瓶内原空气体积的1/5,可能存在的原因是__________(写出一条即可)。
【答案】分子不断运动 吸收二氧化硫,防止污染空气 氧气的浓度不同 难溶于水 红磷不足(或装置漏气等,合理即可)。
【解析】
(1)氨分子不断运动,进入滴有酚酞的蒸馏水中,使酚酞试液变红;
(2)硫燃烧生成二氧化硫,二氧化硫属于空气污染物,所以B、C中集气瓶底部有少量水,其作用是吸收二氧化硫,防止污染空气;燃烧过程中,火焰颜色不同的原因是:氧气的浓度不同;
(3)D实验完毕,集气瓶内水面上升到一定高度后,不能继续上升,这种现象说明氮气具有难溶于水的性质;从烧杯中进入集气瓶内水的体积明显小于瓶内原空气体积的五分之一,可能存在的原因是:红磷量不足,没有把氧气消耗完;装置漏气;没有冷却到室温,就打开了止水夹。
故答案为:
(1)氨分子不断运动;(2)吸收二氧化硫,防止污染空气;氧气的浓度不同;(3)难溶于水;红磷量不足(或装置漏气;没有冷却到室温,就打开了止水夹。)

【题目】某兴趣小组同学对实验室制备氧气的条件进行如下探究实验.
(提出问题)
①氧化铜是否也能作氯酸钾分解的催化剂?②它是否比二氧化锰催化效果更好?
(设计并完成实验)
Ⅰ.将3.0g氯酸钾放在试管中加热
Ⅱ.将3.0g氯酸钾与1.0g二氧化锰均匀混合加热
Ⅲ.将x g氯酸钾与1.0g氧化铜均匀混合加热
(实验现象分析)
Ⅲ中x的值应为_____;将实验Ⅰ和Ⅲ比较可证明_____;将实验Ⅲ反应后的固体加水溶解、过滤、洗涤、干燥,若称量得到1.0g黑色粉末,再将黑色粉末和xg氯酸钾混合加热,现象与实验Ⅲ相同,此步骤是为了证明氧化铜在该化学反应前后_____和_____都不变.
(结论)氧化铜还能作氯酸钾分解的催化剂。
(实验反思)实验Ⅱ和Ⅲ对比是为了证明_____。
(提出问题)②双氧水分解速度还和什么因素有关
(设计并完成实验)
双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生产生O2体积 | |
Ⅰ | 50.0g | 1% | 0.1g | 9mL |
Ⅱ | 50.0g | 2% | 0.1g | 16mL |
Ⅲ | 50.0g | 4% | 0.1g | 31mL |
本实验中,测量O2体积的装置是_____(填编号)
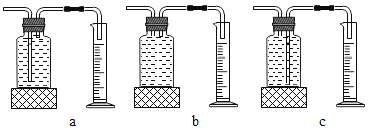
(结论)在相同条件下,双氧水的浓度越大,双氧水分解得越_____。