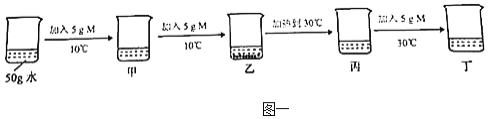
题目内容
【题目】某白色粉末,可能含有硫酸钠、硫酸铜、氯化钠、硝酸钡、碳酸钙中的一种或几种。某科学兴趣小组为探究其成分,设计了如下实验流程(所加试剂均足量)。

(1)操作I、Ⅱ的名称是______。
(2)无色气体的质量是_____克。
(3)固体甲的成分是______。
(4)这种白色粉末中一定不含有_____。
(5)求白色粉末中肯定含有的物质总质量。
【答案】(1)过滤;(2)2.2;(3)碳酸钙与硫酸钠、硝酸钡;(4)硫酸铜;(5)11.87克
【解析】(1)过滤能将难溶性固体与液体分离;(2)据质量守恒定律可知反应前后物质的总质量不变,所以无色气体的质量是7.33g-5.13g=2.2g;(3)固体溶于水得无色溶液,说明固体中一定不含硫酸铜;能与硝酸钡反应生成沉淀说明有硫酸钠,同时,7.33g固体灼烧后得固体余物5.13g,可判断固体中有硝酸钡,溶于水时生成了硫酸钡沉淀;
设碳酸钙的质量为x;
CaCO3 高温CaO+CO2↑
100 44
X 2.2g
100/x=44/2.2g x=5g 所以7.33g固体中硫酸钡的质量为2.33g
设生成2.33克硫酸钡沉淀需要硝酸钡的质量为y
Na2SO4+Ba(NO3)2 = BaSO4↓+ 2NaNO3
261 233
Y 2.33g
261/y=233/2.33g y=2.61g
生成硫酸钡的总质量为6.99g,则硫酸钠的质量为m
Na2SO4+Ba(NO3)2 = BaSO4↓+ 2NaNO3
142 233
m 6.99g
142/m=233/6.99g m=4.26g
固体中一定有的碳酸钙与硫酸钠、硝酸钡的总质量为5g+4.26g+2.61g=11.87g

 阅读快车系列答案
阅读快车系列答案【题目】小柯探究pH对唾液淀粉酶活性的影响,其实验过程及结果如下:
组别 | A | B | C |
试管中依次 加入物质 | 1ml唾液 | 1ml唾液 | 1ml唾液 |
1ml盐酸溶液 | 1ml蒸馏水 | 1ml氢氧化钠溶液 | |
2ml淀粉溶液 | 2ml淀粉溶液 | 2ml淀粉溶液 | |
水浴10分钟 | 37℃ | 37℃ | 37℃ |
各滴入2滴 碘液后的现象 | 变蓝 | 不变蓝 | 不变蓝 |
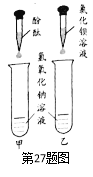
(1)B组实验不变蓝的原因是____________________。小柯观察到C组也不变蓝,认为氢氧化钠对酶的活性没有影响。老师提示他:“氢氧化钠会影响酶的活性。”那么,是什么原因导致C组没变蓝?小柯进一步分析并做出猜想。
猜想一:氢氧化钠变质。
猜想二:氢氧化钠与碘发生了化学反应。
……
(2)小柯按图甲实验,看到溶液变红,认为氢氧化钠没有变质。小常认为他的结论是
错误的,理由是_________________________。
在小常的建议下,小柯按乙实验,溶液中没有沉淀产生,从而排除了猜想一。
(3)在原来C组实验基础上,只要继续_______________________(写出操作和现象),就可以证明猜想二正确。