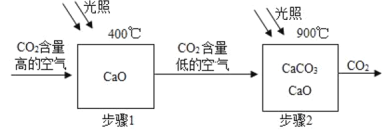
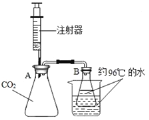
��Ŀ����
����Ŀ����ͼʵ����ʾ������кͷ�Ӧ��ʵ���о�
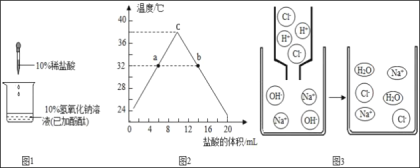
��1���μ�ϡ����ǰ���ձ�����Һ��_____ɫ������ϡ����ϵ�����Һ����ɫ��Ϊ̽����Ӧ��ϡ�����Ƿ��������ѡ�õ��Լ���_____����ѡ���ѡ��
A Ca��OH��2 B п�� C ̼���� D ��ɫʯ����Һ
��2����������ϵ��룬�ձ�����Һ��pH��_____�������С�����䡱��
��3����������ϵ��룬�ձ�����Һ�¶ȱ仯������ͼ2��ʾ������ͼ������ж��з�Ӧ��_____��Ӧ������ȡ������ȡ���
��4��ͼ2��c���ʾ�ĺ�����_____��b����Һ�к��е���������_____��
��5��ͼ3��NaOH��ϡHCl��Ӧ��ʾ��ͼ���û�ѧ��Ӧ����ʽ��ʾΪ_____���Ӹ�ͼ���Կ�������Ӧǰ������Ŀ���ٵ���_____��
���𰸡��� BCD ��С ���� ���ǡ����ȫ�к� Na+��H+ NaOH+HCl��NaCl+H2O H+��OH��
��������
��1���μ�ϡ����ǰ���ձ�����Һ�ʺ�ɫ�����������ԣ���ʹʯ����Һ���ɫ����п��Ӧ�����Ȼ�п����������̼���Ʒ�Ӧ�����Ȼ��ơ�ˮ�Ͷ�����̼�����Ϊ̽����Ӧ��ϡ�����Ƿ��������ѡ�õ��Լ���п����̼���ơ���ɫʯ����Һ���Լ�������죻BCD��
��2����������ϵ��룬������������Ʋ��Ϸ�Ӧ�����Լ������ձ�����Һ��pH��С�������С��
��3����������ϵ��룬�ձ�����Һ�¶������ߺͣ�˵���кͷ�Ӧ�Ƿ��ȷ�Ӧ��������ȣ�
��4��c����¶���ߣ���ʾ���ǡ����ȫ�кͣ�b�����¶Ƚ��͵Ĺ��̣�˵����Ӧ�Ѿ������ˣ������������ʱ��Һ�е��������Ȼ��ƺ��Ȼ��⣬��Һ�е��������������Ӻ������ӣ�������ǡ����ȫ�кͣ�Na+��H+��
��5��NaOH��ϡHCl��Ӧ�����Ȼ��ƺ�ˮ����ѧ��Ӧ����ʽΪ��NaOH+HCl��NaCl+H2O���Ӹ�ͼ���Կ�������Ӧǰ������Ŀ���ٵ���H+��OH����������Ϊ�����Ӻ����������ӽ��������ˮ���ӡ����NaOH+HCl��NaCl+H2O��H+��OH����