题目内容
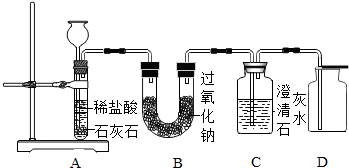 (2012?息县二模)金属过氧化物等可作宇宙飞船或潜水艇中的氧气再生剂,如:过氧化钠(Na2O2)在常温下能与人呼出的二氧化碳反应生成氧气,化学方程式为:2Na2O2+2CO2═2Na2CO3+O2.为了验证该反应中氧气的产生,某兴趣小组的同学设计了如图所示的实验.
(2012?息县二模)金属过氧化物等可作宇宙飞船或潜水艇中的氧气再生剂,如:过氧化钠(Na2O2)在常温下能与人呼出的二氧化碳反应生成氧气,化学方程式为:2Na2O2+2CO2═2Na2CO3+O2.为了验证该反应中氧气的产生,某兴趣小组的同学设计了如图所示的实验.(1)A装置中所发生反应的化学方程式为
CaCO3+2HCl═CaCl2+H2O+CO2↑;
CaCO3+2HCl═CaCl2+H2O+CO2↑;
;实验室确定气体发生装置时应考虑的因素是
反应物的状态和反应条件等
反应物的状态和反应条件等
;检查A装置的气密性的方法是:将A装置中导气管上的胶皮管用弹簧夹夹住,往长颈漏斗中注入水至液面高出漏斗颈的下端管口,若能观察到漏斗颈中形成一段稳定的水柱
漏斗颈中形成一段稳定的水柱
现象,即可证明装置不漏气.(2)表明二氧化碳没有被过氧化钠完全吸收的现象是
C装置处的澄清石灰水变浑浊
C装置处的澄清石灰水变浑浊
.(3)用向上排空气法收集氧气,并用带火星的木条放在集气瓶口检验氧气是否收集满,这是利用了氧气的哪些性质?
(4)如果用脱脂棉包裹一定量的Na2O2固体,然后向其中通入CO2,脱脂棉很快就燃烧此现象说明该反应过程中能量是如何变化的?
(5)常温下水也能与Na2O2反应,生成氧气和氢氧化钠,写出该反应的化学方程式.若要检验干燥的二氧化碳能否与过氧化钠反应生成氧气,以上实验装置应如何改进?
(6)实验室中的过氧化钠如果保存不当,容易与空气中的CO2和水蒸汽发生反应变质.今称取10g过氧化钠样品(杂质不参加反应)放人烧杯中,向其中加入10g水,二者完全反应后.称量烧杯中剩余物质的总质量为18.4g(不包括烧杯的质量,且气体的溶解忽略不计).试计算过氧化钠样品中杂质的质量分数.
分析:实验室制取CO2,是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;二氧化碳的检验方法是:通入澄清的石灰水中,石灰水变浑浊.检查A装置的气密性的方法是:将A装置中导气管上的胶皮管用弹簧夹夹住,往长颈漏斗中注入水至液面高出漏斗颈的下端管口,若能观察到漏斗颈中形成一段稳定的水柱,装置严密.用向上排空气法收集氧气,并用带火星的木条放在集气瓶口检验氧气是否收集满,这是利用了氧气的密度比空气大,氧气能支持燃烧;根据化学方程式的计算要准确.
解答:解:(1)碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,检查A装置的气密性的方法是:将A装置中导气管上的胶皮管用弹簧夹夹住,往长颈漏斗中注入水至液面高出漏斗颈的下端管口,若能观察到漏斗颈中形成一段稳定的水柱,装置严密;气体的制取装置的选择与反应物的状态和反应的条件有关;故答案为:CaCO3+2HCl═CaCl2+H2O+CO2↑;反应物的状态和反应条件等;漏斗颈中形成一段稳定的水柱(或液面不再下降)等
(2)二氧化碳的检验方法是:通入澄清的石灰水中,石灰水变浑浊.故答案为:C装置处的澄清石灰水变浑浊
(3)用向上排空气法收集氧气,并用带火星的木条放在集气瓶口检验氧气是否收集满,这是利用了氧气的密度比空气大,氧气能支持燃烧;故答案为:氧气的密度比空气大,氧气能支持燃烧(或有助燃性)
(4)脱脂棉很快就燃烧此现象说明该反应是放热反应,故答案为:此反应是放热的
(5)常温下水与Na2O2反应,生成氧气和氢氧化钠,配平即可;若要检验干燥的二氧化碳能否与过氧化钠反应生成氧气,在A、B装置之间和B、C装置之间增加气体干燥装置;故答案为:2Na2O2+2H2O═4NaOH+O2↑;在A、B装置之间和B、C装置之间增加气体干燥装置(或盛有浓硫酸的洗气瓶)等.(说明:只要答出在A、B装置之间增加气体干燥装置就给分)
(6)解:生成O2的质量为:10g+10g-18.4g=1.6g
设过氧化钠样品中Na2O2的质量为x
2Na2O2+2H2O═4NaOH+O2↑
2×78 32
x 1.6g
=
X=7.8g
过氧化钠样品中杂质的质量分数为:
×100%=22%
答:过氧化钠样品中杂质的质量分数为22%.
故答案为:22%
(2)二氧化碳的检验方法是:通入澄清的石灰水中,石灰水变浑浊.故答案为:C装置处的澄清石灰水变浑浊
(3)用向上排空气法收集氧气,并用带火星的木条放在集气瓶口检验氧气是否收集满,这是利用了氧气的密度比空气大,氧气能支持燃烧;故答案为:氧气的密度比空气大,氧气能支持燃烧(或有助燃性)
(4)脱脂棉很快就燃烧此现象说明该反应是放热反应,故答案为:此反应是放热的
(5)常温下水与Na2O2反应,生成氧气和氢氧化钠,配平即可;若要检验干燥的二氧化碳能否与过氧化钠反应生成氧气,在A、B装置之间和B、C装置之间增加气体干燥装置;故答案为:2Na2O2+2H2O═4NaOH+O2↑;在A、B装置之间和B、C装置之间增加气体干燥装置(或盛有浓硫酸的洗气瓶)等.(说明:只要答出在A、B装置之间增加气体干燥装置就给分)
(6)解:生成O2的质量为:10g+10g-18.4g=1.6g
设过氧化钠样品中Na2O2的质量为x
2Na2O2+2H2O═4NaOH+O2↑
2×78 32
x 1.6g
| 2×78 |
| x |
| 32 |
| 1.6g |
X=7.8g
过氧化钠样品中杂质的质量分数为:
| 10g-7.8g |
| 10g |
答:过氧化钠样品中杂质的质量分数为22%.
故答案为:22%
点评:本考点主要考查了二氧化碳的制法、检查装置的气密性、氧气的化学性质等,同时也考查了化学方程式的书写和二氧化碳的检验,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.有关的计算要准确,本考点是中考的重要考点之一,主要出现在实验题中.

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
 (2012?息县二模)如图是“铁钉与硫酸铜溶液反应前后质量的测定”的实验,请回答下列问题:
(2012?息县二模)如图是“铁钉与硫酸铜溶液反应前后质量的测定”的实验,请回答下列问题: