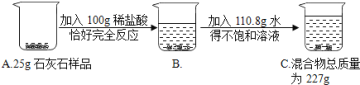
题目内容
【题目】(8分)有一包固体粉末,可能是NaOH、Na2SO4、MgCl2、CuSO4中的一种或几种组成,为了分析固体粉末的成分,取少量该固体粉末进行实验,实验方案设计如下:
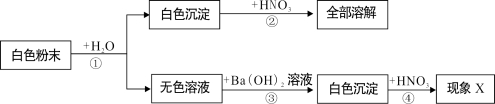
(1)固体粉末中一定有 ,一定没有 .
(2)若现象X为“沉淀不溶解”或“沉淀部分溶解”,结论是固体粉末中 ;若现象X为“沉淀全部溶解”,结论是固体粉末中 。
(3)实验步骤①和③都有相同的实验操作,该操作名称为 。
(4)写出实验步骤②的化学方程式 。
(5)简单修改上述实验方案,可取消第④步实验,修改的方法是 。
【答案】(1)NaOH和MgCl2,CuSO4;(方程式2分,其余每空1分)(2)一定有Na2SO4,一定没有Na2SO4;(3)过滤;(4)Mg(OH)2+2HNO3═Mg(NO3)2+2H2O;(5)把第③步使用的Ba(OH)2溶液改为BaCl2溶液(或Ba(NO3)2溶液).
【解析】
试题分析:(1)由无色溶液可知,固体粉末中一定不含硫酸铜,硫酸铜溶液为蓝色;白色沉淀是NaOH和MgCl2反应生成的,则一定含有氢氧化钠和氯化镁;(2)硫酸钡不溶于硝酸,则若现象X为“沉淀不溶解”或“沉淀部分溶解”,结论是固体粉末中一定有Na2SO4,若现象X为“沉淀全部溶解”,结论是固体粉末中一定没有Na2SO4;(3)将沉淀与液体分离的方法是过滤;(4)写出实验步骤②的化学方程式为:Mg(OH)2+2HNO3═Mg(NO3)2+2H2O;(5)把第③步使用的Ba(OH)2溶液改为BaCl2溶液,氯化钡和硫酸钠反应,生成硫酸钡沉淀,硫酸钡不溶于稀硝酸。

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目