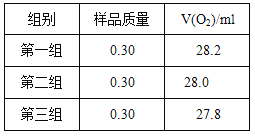
题目内容
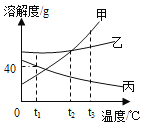
【题目】右图是a、b、c三种物质的溶解度曲线.下列叙述错误的是
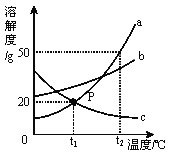
A.t1℃时,a、c的溶解度相等
B.t1℃时,a物质饱和溶液中溶质、溶剂的质量比为1∶5
C.t2℃时a、b、c的饱和溶液降温到0℃后,C溶液的溶质质量分数最大
D.t2℃时30 g a物质的饱和溶液稀释成20%溶液需加入水的质量为20 g
【答案】C
【解析】
试题分析:A、根据溶解度曲线可知,t1℃时,a、c的溶解度都为20g,故A正确;B、t1℃时,a的溶解度为20g,即100g水中最多溶解物质a的质量20g,故a物质的饱和溶液中溶质、溶剂的质量比为1:5,故B正确;C、根据溶解度曲线可知,t2℃时a、b、c的溶解度关系为a〉b〉c,根据饱和溶液中溶质质量分数的计算公式:![]() ,可以判断三者的质量分数关系为a〉b〉c,降温到0℃后a、b均有晶体析出,还是饱和溶液,此时溶解度a<b,则质量分数关系为a<b,c的溶解度随温度降低而升高,c由饱和溶液变为不饱和溶液,由于c溶液中溶质和溶剂的质量都未发生改变,故其溶质质量分数不变,由于t1℃时a的溶解度大于t2℃时c的溶解度,可知温度降至0℃后,a、c的溶质质量分数关系为a〉c,故可得a、b、c溶液的溶质质量分数由大到小的顺序为b〉a〉c,故C错误;D、根据溶液稀释前后溶质质量不变,设需要加水的质量为x,则30×(50/100+50)=(30+x) ×20%,求得x=20g,故D正确。选C。
,可以判断三者的质量分数关系为a〉b〉c,降温到0℃后a、b均有晶体析出,还是饱和溶液,此时溶解度a<b,则质量分数关系为a<b,c的溶解度随温度降低而升高,c由饱和溶液变为不饱和溶液,由于c溶液中溶质和溶剂的质量都未发生改变,故其溶质质量分数不变,由于t1℃时a的溶解度大于t2℃时c的溶解度,可知温度降至0℃后,a、c的溶质质量分数关系为a〉c,故可得a、b、c溶液的溶质质量分数由大到小的顺序为b〉a〉c,故C错误;D、根据溶液稀释前后溶质质量不变,设需要加水的质量为x,则30×(50/100+50)=(30+x) ×20%,求得x=20g,故D正确。选C。

练习册系列答案
相关题目