题目内容
【题目】有一包白色固体粉末,可能含有CuSO4、Na2SO4、(NH4)2CO3、BaCl2、NH4Cl、KCl中的一种或几种.现做如下实验: 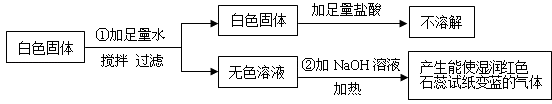
根据上述实验现象判断:
(1)白色固体中一定不含 , 一定含有 , 可能含有 .
(2)写出①中化学反应方程式 .
(3)写出②中化学反应方程式 .
【答案】
(1)CuSO4、(NH4)2CO3;Na2SO4、BaCl2、NH4Cl;KCl
(2)Na2SO4+BaCl2=BaSO4↓+2NaCl
(3)NaOH+NH4Cl ![]() ?NaCl+NH3↑+H2O
?NaCl+NH3↑+H2O
【解析】解:(1)由步骤①可知,白色固体中一定没有硫酸铜,因为硫酸铜溶于水呈蓝色;过滤得到的白色固体加入足量的盐酸不溶解,因此白色固体中一定有硫酸钡,原物质中一定有了氯化钡和硫酸钠,就一定不能再有碳酸铵了,因为碳酸钡溶于盐酸,此白色固体是硫酸钡,说明原混合物中一定有Na2SO4、BaCl2;由步骤②可知,加入氢氧化钠溶液加热,产生了能使湿润的红色石蕊试纸变蓝的气体,此气体是氨气,因此原白色固体中一定含有氯化铵;KCl可能有也可能没有;故答案为:CuSO4、(NH4)2CO3; Na2SO4、BaCl2、NH4Cl; KCl (2)硫酸钠和氯化钡反应生成硫酸钡白色沉淀和氯化钠,配平即可,故答案为:Na2SO4+BaCl2=BaSO4↓+2NaCl(3)氢氧化钠和氯化铵在加热的条件下反应生成氯化钠和水和氨气,故答案为:NaOH+NH4Cl ![]() NaCl+NH3↑+H2O 根据题目给出的流程图和信息:由步骤①可知,白色固体中一定没有硫酸铜,因为硫酸铜溶于水呈蓝色;过滤得到的白色固体加入足量的盐酸不溶解,因此白色固体中一定有硫酸钡,原物质中一定有了氯化钡和硫酸钠,就一定不能再有碳酸铵了,因为碳酸钡溶于盐酸,此白色固体是硫酸钡,说明原混合物中一定有Na2SO4、BaCl2;由步骤②可知,加入氢氧化钠溶液加热,产生了能使湿润的红色石蕊试纸变蓝的气体,此气体是氨气,因此原白色固体中一定含有氯化铵;KCl可能有也可能没有.硫酸钠和氯化钡反应生成硫酸钡白色沉淀和氯化钠,配平即可;氢氧化钠和氯化铵在加热的条件下反应生成氯化钠和水和氨气.
NaCl+NH3↑+H2O 根据题目给出的流程图和信息:由步骤①可知,白色固体中一定没有硫酸铜,因为硫酸铜溶于水呈蓝色;过滤得到的白色固体加入足量的盐酸不溶解,因此白色固体中一定有硫酸钡,原物质中一定有了氯化钡和硫酸钠,就一定不能再有碳酸铵了,因为碳酸钡溶于盐酸,此白色固体是硫酸钡,说明原混合物中一定有Na2SO4、BaCl2;由步骤②可知,加入氢氧化钠溶液加热,产生了能使湿润的红色石蕊试纸变蓝的气体,此气体是氨气,因此原白色固体中一定含有氯化铵;KCl可能有也可能没有.硫酸钠和氯化钡反应生成硫酸钡白色沉淀和氯化钠,配平即可;氢氧化钠和氯化铵在加热的条件下反应生成氯化钠和水和氨气.

【题目】化学是一门以实验为基础的自然学科.下列是初中化学课堂演示实验或学生分组实验的部分实验图示,请根据实验图示说出实验目的、现象、结论、物质的性质和作用、化学反应的方程式:
实验编号 | 实验① | 实验② | 实验③ | 实验④ |
实验图示 |
|
|
| |
实验编号 | 实验⑤ | 实验⑥ | 实验⑦ | 实验⑧ |
实验图示 |
|
| |
|
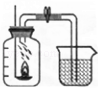
(1)实验①中,用于测定空气中氧气的含量,实验所用的物质是(木炭、磷、铁丝).
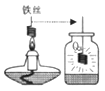
(2)实验②中,预先在集气瓶里装有少量的水,其目的是 .
(3)实验③中,制取气体的化学反应方程式是;收集气体用向上排空气法,说明制取气体的密度比空气的密度(填“大”或“小”或“相同”);证明集气瓶里已收集满气体的实验操作方法是 .
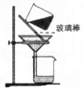
(4)实验④中,将溶液进行过滤得操作时,玻璃棒在实验过程中所起的作用是
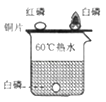
(5)实验⑤中,观察到烧杯A中溶液逐渐变成红色,该实验的结论是 .
(6)实验⑥中,根据水中白磷没有燃烧的原理,举出生活中一灭火的事例如 .
(7)实验⑦中,向烧杯里燃着阶梯蜡烛倾倒CO2气体,观察到的现象是 .
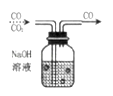
(8)实验⑧中,用于除去CO中少量的CO2 , 溶液里发生的化学反应方程式是 .
【题目】下列图象能正确反映对应变化关系的是( )
序号 | 实验内容 | x轴含义 | y轴含义 | 坐标图 |
① | 向一定量铁粉和铜粉中不断滴加硫酸铜溶液 | 硫酸铜溶液质量 | 单质铜的质量 | |
② | 向氢氧化钠溶液中逐滴加入稀盐酸 | 稀盐酸质量 | 所得溶液中水的质量 | |
③ | 一定温度下,向某不饱和氯化钠溶液中加入氯化钠固体 | 加入氯化钠质量 | 溶液中溶质的质量分数 | |
④ | 加热高锰酸钾制取氧气 | 加热时间 | 剩余固体 |
A.①②
B.③④
C.①③
D.②④