题目内容
将氯化钙和碳酸钙的混合物12g放入一个烧杯中,然后往其中加入123.4g稀盐酸,恰好完全反应,称量反应后剩余物质的总质量为131g.计算:
(1)生成二氧化碳的质量是多少?
(2)反应后所得溶液中溶质的质量分数是多少?
| (1)根据质量守恒定律,生成二氧化碳的质量等于氯化钙和碳酸钙的混合物的质量加上稀盐酸的质量减去反应后剩余物质的总质量; (2)根据化学方程式利用生成的二氧化碳的质量计算出混合物中碳酸钙的质量和生成的氯化钙的质量,溶质有两部分,一是生成的氯化钙,一是原混合物在的氯化钙,原混合物中的氯化钙可以用混合物的质量减去碳酸钙的质量获得,最后利用质量分数公 | |
| 解答: | 解:(1)根据质量守恒定律,生成二氧化碳的质量=12g+123.4g﹣131g=4.4g; (2)设原混合物中含有碳酸钙的质量为x,生成氯化钙的质量为y,则 CaCO3+2HCl=CaCl2+H2O+CO2↑ 100 111 44 x y 4.4g
反应后所得溶液中溶质的质量分数是 答:(1)生成二氧化碳的质量是4.4g; (2)反应后所得溶液中溶质的质量分数是10%. |

练习册系列答案
 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
 式
式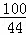 =
= ,解得x=10g;
,解得x=10g; =
= ,解得y=11.1g;
,解得y=11.1g; ×100%=10%.
×100%=10%.