题目内容
【题目】把一定质量的锌粉投入到硫酸亚铁和硫酸铜的混合溶液A中,充分搅拌,过滤。回答下列问题。
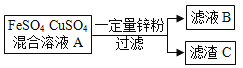
(1)若向滤渣C中加入适量稀硫酸,有气体生成。滤渣C中一定有_____,滤液B中除水外,一定有_____。
(2)若向溶液A中加入过量的锌粉,写出向滤渣C中加入足量硫酸,发生的反应的化学方程式为_____、_____。
【答案】Cu、Fe ZnSO4 H2SO4+Fe=FeSO4+H2↑ H2SO4+Zn=ZnSO4+H2↑
【解析】
在这三种金属的活动性顺序中,锌比铁活泼,铁比铜活泼,一定质量的锌粉投入到硫酸亚铁和硫酸铜的混合溶液中,锌先与硫酸铜反应,再与硫酸亚铁反应。
(1)向滤渣C中加入适量稀硫酸,有气体生成,可知滤渣中含有较活泼金属,锌能置换铁和铜,而铜不与稀硫酸反应产生气体,故滤渣C中一定有铁、铜,滤液B中除水外,一定有生成的硫酸锌。
(2)若向溶液A中加入过量的锌粉,则滤渣C中含有锌、铁和铜,加入足量硫酸,锌和铁分别能与稀硫酸发生的反应,化学方程式为H2SO4+Fe=FeSO4+H2↑、H2SO4+Zn=ZnSO4+H2↑。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目