题目内容
某化学实验小组要检测黄铜(铜、锌合金)中金属铜的纯度,同学们取20g黄铜样品,向其中分三次共加入15g盐酸溶液,充分反应后测得实验结果如下:
|
实验次数 |
1 |
2 |
3 |
|
盐酸质量 |
5g |
5g |
5g |
|
氢气质量 |
0.04g |
m |
0.02g |
请计算:(1)第二次实验产生氢气的质量m= g。
(2)黄铜(铜、锌合金)中金属铜的纯度。
解:(1)0.04g; (2)83.75%
【解析】
试题分析:(1)根据第一、三组中加入盐酸的量和生成的气体质量进行分析;
(2)根据生成氢气的量和锌与盐酸反应的方程式中的等量关系进行分析。
解:(1)第一次加5克盐酸生成0.04克氢气,第三次加5克的盐酸还生成了0.02克的氢气,说明第二次反应中金属是过量的,也生成0.04克氢气,故答案为:0.04g;
(2)解:设共生成(0.04g+0.04g+0.02g=0.1g)氢气,需金属锌的质量为x
Zn+2HCl=ZnCl2+H2↑
65 2
x 0.1g
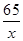 =
=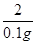
X=3.25g
合金中铜的质量分数即纯度: ×100%=83.75%
×100%=83.75%
答:黄铜(铜、锌合金)中金属铜的纯度为:83.75%
考点:考查根据化学反应方程式的计算;质量守恒定律及其应用

 快乐5加2金卷系列答案
快乐5加2金卷系列答案| 实验次数 | 1 | 2 | 3 |
| 盐酸质量 | 5g | 5g | 5g |
| 氢气质量 | 0.04g | m | 0.02g |
(2)黄铜(铜、锌合金)中金属铜的纯度.
某化学实验小组要检测黄铜(铜、锌合金)中金属铜的纯度,同学们取20g黄铜样品,向其中分三次共加入15g盐酸溶液,充分反应后测得实验结果如下:
| 实验次数 | 1 | 2 | 3 |
| 盐酸质量 | 5g | 5g | 5g |
| 氢气质量 | 0.04g | m | 0.02g |
请计算:(1)第二次实验产生氢气的质量m g。
(2)黄铜(铜、锌合金)中金属铜的纯度。
某化学实验小组要检测黄铜(铜、锌合金)中金属铜的纯度,同学们取20g黄铜样品,向其中分三次共加入15g盐酸溶液,充分反应后测得实验结果如下:
| 实验次数 | 1 | 2 | 3 |
| 盐酸质量 | 5g | 5g | 5g |
| 氢气质量 | 0.04g | m | 0.02g |
请计算:(1)第二次实验产生氢气的质量m= g。
(2)黄铜(铜、锌合金)中金属铜的纯度。
| 实验次数 | 1 | 2 | 3 |
| 盐酸质量 | 5g | 5g | 5g |
| 氢气质量 | 0.04g | m | 0.02g |
(2)黄铜(铜、锌合金)中金属铜的纯度.
| 实验次数 | 1 | 2 | 3 |
| 盐酸质量 | 5g | 5g | 5g |
| 氢气质量 | 0.04g | m | 0.02g |
(2)黄铜(铜、锌合金)中金属铜的纯度.