题目内容
【题目】某实验小组为探究酸的化学性质,由甲、乙同学设计并完成了如图所示的实验.
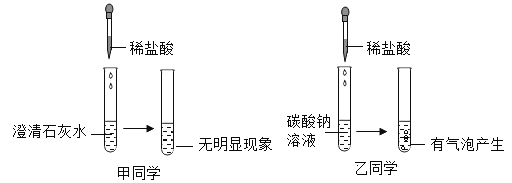
(1)甲同学实验中所发生的化学方程式为__________________________________.
(查阅资料)CaCl2、NaCl的溶液呈中性,Na2CO3溶液呈______(填“酸”或“碱”)性.
(实验探究一)确定甲、乙同学上述实验后所得溶液中的溶质.
(2)取甲所得溶液少许,加入石蕊试液,溶液显红色,甲所得溶液中一定含有的溶质是______(写化学式)
(3)取乙所得溶液少许,加入酚酞试液,溶液显红色,乙所得溶液中一定含有的溶质是______(写化学式)
(实验探究二)
(4)甲、乙同学把上述实验所得溶液倒入同一废液缸中,观察到废液缸中产生少量气泡,最终有白色沉淀生成,该白色沉淀是__________(写化学式).
(讨论交流)丙同学提出:若将上述废缸中物质取出,过滤,所得滤液中含有哪些物质呢?经过讨论大家一致认为:一定含有NaCl,可能含有CaCl2、盐酸和Na2CO3中的部分物质.
(实验探究三)取少量滤液于试管中,滴加过量的稀硝酸,可观察到有大量气泡产生.
(归纳总结)该滤液中含有的溶质是氯化钠和_________(写化学式).
(探索与拓展)有一份由Na2SO4、NaCl两种物质组成的固体样品.为确定其组成,上述小组同学将样品全部溶于蒸馏水中制成119.3g溶液,再往其中加入104gBaCl2溶液,两者恰好完全反应.过滤,得到23.3g白色沉淀和一定质量的滤液.经测定,该滤液中溶质质量分数为9%.试计算:(均需计算过程)
(5)所用B2Cl2的溶液中溶质的质量分数_______.
(6)所用样品的质量________________________.
【答案】Ca(OH)2+2HCl=CaCl2+2H2O 碱性 CaCl2和 HCl NaCl 和 Na2CO3 CaCO3 Na2CO3 20%(过程见解析) 18.25g(过程见解析)
【解析】
(1)甲同学实验是氢氧化钙与稀盐酸的反应;Na2CO3溶液显碱性;
(2)取甲所得溶液少许,加入石蕊试液,溶液显红色,说明溶液显酸性,所以甲所得溶液中一定含有的溶质CaCl2和 HCl;
(3)取乙所得溶液少许,加入酚酞试液,溶液显红色,说明溶液显碱性,所以乙所得溶液中一定含有的溶质NaCl 和 Na2CO3;
(4)甲、乙同学把上述实验所得溶液倒入同一废液缸中,发生的化学反应是Na2CO3+2HCl=2NaCl+H2O+CO2↑,Na2CO3+CaCl2=CaCO3↓+2NaCl,所以白色沉淀是CaCO3;
[归纳总结]取少量滤液于试管中,滴加过量的稀硝酸,可观察到有大量气泡产生,说明有碳酸钠,该滤液中含有的溶质是氯化钠和碳酸钠.
解:设所用BaCl2的溶液中溶质的质量为x,设原混合物中硫酸钠的质量为z,生成氯化钠的质量为y.
Na2SO4+BaCl2=BaSO4↓+2NaCl
142 208 233 117
z x 23.3g y
![]()
x=20.8g
![]()
y=11.7g
![]()
z=14.2g
(5)所用BaCl2的溶液中溶质的质量分数![]() =20%;
=20%;
(6)假设样品的质量为W,则![]() ×100%=9%
×100%=9%
所以W=18.25g
故答案:Ca(OH)2+2HCl=CaCl2+2H2O;碱性;CaCl2和 HCl;NaCl 和 Na2CO3;CaCO3;Na2CO3;20%;18.25g。

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案【题目】甲、乙、丙三种物质间通过一步反应能实现右图转化,下列选项中符合图示转化关系的是
选项 | 甲 | 乙 | 丙 |
A | NaOH | NaCl | NaNO3 |
B | CuO | CuCl2 | Cu(OH)2 |
C | Na2CO3 | CO2 | CaCO3 |
D | H2O2 | H2O | O2 |

A. A B. B C. C D. D
【题目】填写下列物质的名称或化学式,并指出类别(非金属单质、金属单质、化合物或氧化物)
物质名称 | _____ | 碳酸钙 | _____ | _____ |
化学式 | _____ | _____ | SiO2 | Ca(OH)2 |
类别 | 非金属单质 | _____ | _____ | _____ |