题目内容
(2011?宜昌模拟)为了从硝酸亚铁和硝酸银的混合溶液中,提取并回收银,小燕设计了如下的实验方案: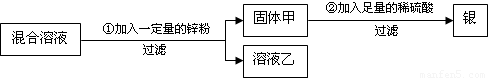
(1)若溶液乙为无色溶液,则固体甲一定含有的物质是______,可能含有的物质是______,写出一个在步骤①中肯定发生的反应的化学方程式______.
(2)若溶液乙为浅绿色溶液,则溶液乙中溶质的组成可能是______或______(填物质的名称或化学式).
【答案】分析:在金属活动性顺序中,锌>铁>氢>银,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.
解答:解:
(1)在金属活动性顺序中,锌>铁>银,加入的锌粉能与硝酸银反应生成银,能与硝酸亚铁反应生成铁,生成的铁能与硝酸银反应生成银和硝酸亚铁,故加入的锌粉首先与硝酸银反应,溶液乙为无色溶液,说明硝酸亚铁已全部参加反应,故生成的金属有银和铁,锌有可能剩余,所以本题答案为:Ag,Fe、Zn,Zn+2AgNO3═Zn(NO3)2+2Ag;
(2)溶液乙为浅绿色溶液,则硝酸亚铁未全部参加反应,溶液中一定有硝酸亚铁,锌粉能与硝酸银反应生成硝酸锌,溶液中一定含有硝酸锌,加入的锌粉若适量,则硝酸银全部参加反应,若加入的锌粉少量,则硝酸银未全部参加反应,所以本题答案为:Zn(NO3)2、Fe(NO3)2或Zn(NO3)2、Fe(NO3)2、AgNO3.
点评:本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.
解答:解:
(1)在金属活动性顺序中,锌>铁>银,加入的锌粉能与硝酸银反应生成银,能与硝酸亚铁反应生成铁,生成的铁能与硝酸银反应生成银和硝酸亚铁,故加入的锌粉首先与硝酸银反应,溶液乙为无色溶液,说明硝酸亚铁已全部参加反应,故生成的金属有银和铁,锌有可能剩余,所以本题答案为:Ag,Fe、Zn,Zn+2AgNO3═Zn(NO3)2+2Ag;
(2)溶液乙为浅绿色溶液,则硝酸亚铁未全部参加反应,溶液中一定有硝酸亚铁,锌粉能与硝酸银反应生成硝酸锌,溶液中一定含有硝酸锌,加入的锌粉若适量,则硝酸银全部参加反应,若加入的锌粉少量,则硝酸银未全部参加反应,所以本题答案为:Zn(NO3)2、Fe(NO3)2或Zn(NO3)2、Fe(NO3)2、AgNO3.
点评:本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目