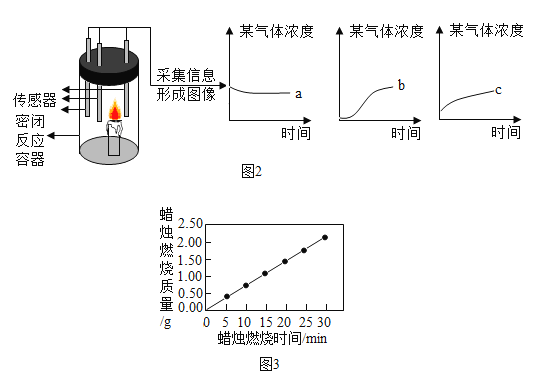
题目内容
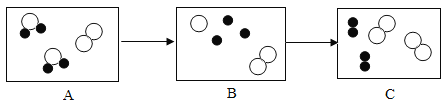
【题目】在20℃时,将等质量的a、b两种固体,分别加入到盛有100g水的烧杯中,充分搅拌后现象如图甲,升温到50℃时:现象如图乙;a:b两种固体的溶解度曲线如图丙。
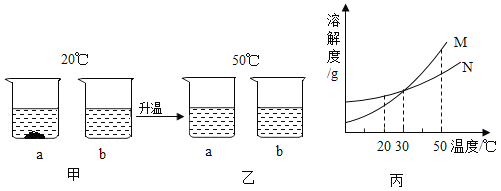
(1)图丙中M表养___的溶解度曲线。
(2)图甲中b溶液为___(填“饱和”“不饱和”或“不确定”)溶液。
(3)30℃时两烧杯中溶液的溶质质量分数关系是a____(填“>”或=或者“<”)b.
(4)若使20℃时a烧杯中未溶的固体继续溶解,除升温外还可以采用的方法是___。
【答案】a 不确定 = 增加水
【解析】
(1)20℃时,N物质的溶解度大于M物质的溶解度,甲图中a烧杯有固体剩余,所以图丙中M表示a的溶解度曲线;
(2)图甲中b溶液底部没有固体剩余,所以不确定是否为饱和溶液;
(3)在20℃时,将等质量的a、b两种固体,分别加入到盛有100g水的烧杯中,到30℃时,固体全部溶解,所以两烧杯中溶液的溶质质量分数关系是a=b;
(4)若使20℃时a烧杯中未溶的固体继续溶解,除升温外还可以采用的方法是增加水。
故答案为:(1)a;
(2)不确定;
(3)=;
(4)增加水。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案【题目】阅读下面的科普材料。
在夏季到来之前,昆明市卫生健康委员会综合监督执法局对全市游泳场所开展了卫生监督检查和游泳池水质抽检工作。根据《游泳场所卫生标准》要求,游泳池水质检测项目为细菌总数、大肠菌群、pH值、浑浊度、尿素、游离性余氯6项指标。其中游离性余氯指标过高会对人体健康造成危害,引起皮肤过教等症状,过低起不到杀菌消毒作用,会造成游泳池水质的恶化,导致多种介水疾病的传播。游泳池水中的游离性余氯主要来自于消春使用的含氯消毒剂。
常见的含氯消毒剂
消毒剂名称 | 液氯 | 漂白粉 | 二氧化氯 |
成分或主要成分 | Cl2 | 次氯酸钙Ca(ClO)2 | ClO2 |
氯气和漂白粉能消毒的主要原因是它们都能与水反应生成次氯酸(HClO)。由于次氯酸具有很强的氧化性,能破坏细菌、病毒的结构,从而可达到杀菌的目的。同时次氯酸具有很强的漂白作用,能使有色物质褪色。次氯酸酸性较弱且极不稳定,在光照条件下极易分解产生HCl和O2
ClO2是一种具有高效、广谱性的消毒剂,能杀死病毒、细菌、原生生物、藻类、真菌等。因其在消毒过程中无“三致效应”(致癌、致畸、致突变),也不产生其它有毒物质,故ClO2被国际上公认为安全、无毒的绿色消毒剂。
根据材料回答下列问题:
(1)游泳池水中的游离性余氯主要来自于________。
(2)常见的含氯消毒剂的成分或主要成分中属于单质的是________(填化学式)。
(3)工业上用漂白粉消毒时涉及到的化学方程式为:![]() ,其中X的化学式为________
,其中X的化学式为________
(4)ClO2被国际上公认为安全、无毒的绿色消毒剂的原因是________。
(5)在次氯酸溶液中滴加紫色石蕊溶液,观察到溶液先由紫色变为红色,后逐渐变为无色。请结合材料解释溶液最终变为无色的原因是________。
【题目】实验室对一瓶未知溶质质量分数的H2SO4溶液进行测定,取20.0g硫酸样品于锥形瓶中,逐滴加入16%的NaOH溶液,并对溶液进行pH监测,所得数据如表所示:
滴加NaOH溶液的质量/g | 9.0 | 9.4 | 9.8 | 10.0 | 10.2 |
溶液的pH | 1.8 | 2.1 | 2.6 | 7.0 | 11.4 |
请回答:
(1)当滴加NaOH溶液的质量为9.4g时,溶液中的溶质是________。
(2)计算所测H2SO4溶液中溶质的质量分数。______