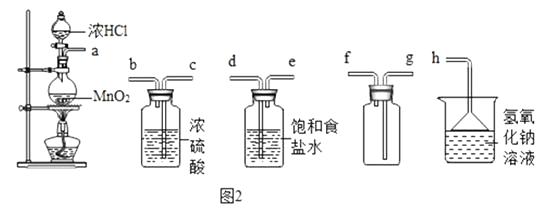
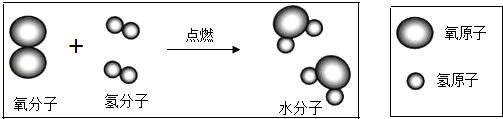
��Ŀ����
����Ŀ��ij��ѧ��ȤС��Ϊ�˲ⶨһ��ʯ��ʯ��Ʒ��̼��Ƶ�����������ȡ��2gʯ��ʯ��Ʒ����20gϡ���ᣨ�Ȼ����ˮ��Һ����4�μ�����Ʒ�У���Ʒ�г�̼����⣬�����ɷݼȲ������ᷴӦ��Ҳ������ˮ������ַ�Ӧ�����ˡ�����Ȳ���������������ʵ�����������
ϡ��������� | ʣ���������� |
��һ�μ���5g | 1.5 g |
�ڶ��μ���5g | M |
�������5g | 0.5g |
���Ĵμ���5g | 0.3g |
��1���ϱ���M����ֵӦΪ
��2�����������ݿ�֪�����Ĵ������е��������ʯ��ʯ��Ʒ�е�̼�������ȫ��Ӧ
��3����ʯ��ʯ��Ʒ��ϡ�����ַ�Ӧ������������ٿˣ�
���𰸡�
��1��1g
��2����
��3���⣺���ܵõ�������̼������Ϊx��
CaCO3+ | 2HCl�T | CaCl2+H2O+ | CO2�� |
100 | 44 | ||
1.7g | x |
![]()
x=0.748g
���ܵõ�������̼������Ϊ0.748g��
����������1����һ�μ���5gϡ�����ʣ������������1.5g����Ӧ��̼�������Ϊ��2g��1.5g=0.5g��˵��5gϡ�����ܺ�0.5g̼���ǡ����ȫ��Ӧ���ڶ��μ���5gϡ��������̼���������ʣ����������Ӧ��Ϊ��1.5g��0.5g=1g��������M����ֵӦΪ1g�����1g��
��2���ɱ������ݷ�����֪�����Ĵ������е��Ĵμ���5gϡ�����ʣ������������0.3g��˵�����Ĵ�ʵ���ʯ��ʯ��Ʒ�е�̼�������ȫ��Ӧ��
����ģ�
�ʴ�Ϊ����1��1g����2����
��3���⣺���ܵõ�������̼������Ϊx��
CaCO3+ | 2HCl�T | CaCl2+H2O+ | CO2�� |
100 | 44 | ||
1.7g | x |
![]()
x=0.748g
���ܵõ�������̼������Ϊ0.748g��
�ɼ���������ÿ�ι�����ٵ�������֪��5����������0.5�˹��壬��������ÿ0.5�˵����������������Ĵ�ʱ��Ӧ��û�й����ˣ������л���0.3�ˣ��ɴ˿��Կ�����ʱ̼��Ʒ�Ӧ���ˣ����Եó�̼����ܹ���1.7�ˣ�ʣ��Ϊ���ʣ�Ҫ�����ɶ�����̼���������������÷���ʽͨ��̼��Ƶ��������㡣����⿼��ѧ�������ݵķ����ʹ���������ʯ��ʯ�к������ʣ�Ӧ�������е�����������ѧ��Ҫע�⡣

 ��ĩ��ϰ���ϵ�д�
��ĩ��ϰ���ϵ�д� ����ѧ�䵥Ԫ������ĩר����100��ϵ�д�
����ѧ�䵥Ԫ������ĩר����100��ϵ�д� �Ƹ�360�ȶ����ܾ�ϵ�д�
�Ƹ�360�ȶ����ܾ�ϵ�д� ���⿼����Ԫ���Ծ�ϵ�д�
���⿼����Ԫ���Ծ�ϵ�д�