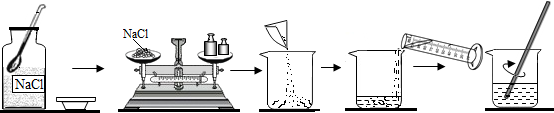
题目内容
在Zn(NO3)2、Cu(NO3)2、AgNO3的混合溶液中,加入一定量的铁粉,充分反应后过滤,在滤渣中加入稀盐酸,有气体放出,则下列结论中正确的是( )
| A、滤渣中只含Ag和Cu,一定无Zn |
| B、滤渣中只含Ag、Cu和Fe,一定无Zn |
| C、滤渣中只含Ag、Cu、Fe和Zn |
| D、滤液中只含Fe(NO3)2 |
考点:金属的化学性质
专题:金属与金属材料
分析:在金属活动性顺序中,Zn>Fe>H>Cu>Ag,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来;在滤渣中加入稀盐酸,有气体放出,说明滤渣中含有铁,说明铁过量,据此分析.
解答:解:由于在金属活动性顺序中,Zn>Fe>H>Cu>Ag,向AgNO3、Cu(NO3)2和Zn(NO3)2的混合溶液中加入一定量的铁粉,铁能与AgNO3、Cu(NO3)2反应,不能与Zn(NO3)2反应;由往滤渣中加入稀盐酸,有无色气体放出,说明了铁一定有剩余.则滤出的固体中一定有Ag、Cu、Fe,一定没有锌;滤液中一定含有滤液中一定有的溶质没反应的Zn(NO3)2和反应生成的Fe(NO3)2,一定没有Cu(NO3)2和AgNO3,由以上分析可知,选项为:B.
点评:本题难度较大,主要考查了对金属活动性顺序的应用,从而培养学生的分析能力和应用能力.注意活动性强的金属放入活动性弱的金属的混合盐溶液中,活动性强的金属会先把活动性最弱的金属从其盐溶液中置换出来,然后再置换活动性较弱的金属.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
2012年12月份,我省多地出现大雾天气,下列说法正确的是( )
| A、雾是由空气中的水蒸气液化形成的 |
| B、雾的形成是液态水在高温下汽化形成 |
| C、雾天能见度下降是光沿直线传播造成的 |
| D、雾是水蒸气悬浮在空气中形成的 |
下列物质名称中加点的字的意义与化学式中加点元素无关的是( )
A、
| ||||||
B、
| ||||||
C、
| ||||||
D、氯化
|
国家卫生部紧急叫停含禁用药物“西布曲明”的减肥药物--“阳光塑身牌减肥胶囊”.已知“西布曲明”的化学式为C17H26ClN,下列有关“西布曲明”的说法不正确的是( )
| A、“西布曲明”是由C、H、Cl、N四种元素组成 |
| B、“西布曲明”被卫生部禁用,应该对身体有害 |
| C、“西布曲明”的一个分子中含有26个氢原子 |
| D、“西布曲明”中C、H、Cl、N各元素的质量比为17:26:1:1 |
下列变化中,属于物理变化的是( )
| A、粮食发酵 |
| B、钠原子与氯原子相互作用,变成钠离子和氯离子 |
C、 用盾构机(如图)挖掘地铁隧道 |
| D、用稀盐酸除去铁锈 |
正确的实验操作对实验结果、人身安全都非常重要.下列实验操作正确的是( )
A、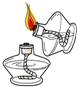 点燃酒精灯 |
B、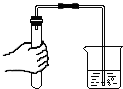 检验气密性 |
C、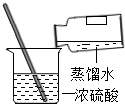 稀释浓硫酸 |
D、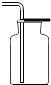 收集氢气 |
下列处理事故的方法中不正确的是( )
| A、炒菜时油锅着火,用锅盖盖灭 |
| B、图书、档案着火,用二氧化碳灭火器扑灭 |
| C、家用电器着火,用水扑灭 |
| D、液化气泄漏时,立即关闭阀门并开窗通风 |
下列有关水的说法正确的是( )
| A、不含或含较少可溶性钙,镁化合物的水是软水 |
| B、生活污水可以直接排放,但工业废水不行 |
| C、净化水时可用活性炭作杀菌剂 |
| D、水分子可热胀冷缩 |