题目内容
 (2013?北辰区一模)实验室欲配制一定溶质质量分数的KNO3溶液,现只有含少量NaCl的KNO3固体样品.
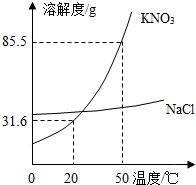
(2013?北辰区一模)实验室欲配制一定溶质质量分数的KNO3溶液,现只有含少量NaCl的KNO3固体样品.(1)查阅KNO3和NaCl的溶解度曲线,从图中可得到的一条信息是
20℃时KNO3的溶解度为31.6g
20℃时KNO3的溶解度为31.6g
(合理即可).50℃时,将85.5g固体样品溶于100g水中,得到的是KNO3的不饱和
不饱和
(填“饱和”或“不饱和”)溶液.将KNO3提纯的方法是降温结晶(冷却热的饱和溶液)
降温结晶(冷却热的饱和溶液)
.(2)小明用提纯后的KNO3固体配制1000g溶质质量分数为5%的KNO3溶液.经检测,小明所配溶液中KNO3溶质质量分数偏小,其原因可能是
①②
①②
.①KNO3固体仍然不纯 ②溶解前,烧杯中有少量水
③量取水时,俯视读数 ④装瓶时,有少量溶液洒出
(3)小红提出,也可用一定量20℃时31.6%的KNO3溶液稀释配制5%的溶液,你认为是否可行
不行
不行
(填“行”或“不行”).(4)现有200g溶质质量分数为10%的硝酸钾溶液,若使溶液的溶质质量分数增加一倍,应向溶液中加入硝酸钾
25
25
g,或蒸发掉水100
100
g.分析:(1)根据提纯物质的溶解度与温度的关系考虑,根据50℃时硝酸钾的溶解度进行分析,根据固体物质从溶液中结晶析出的方法考虑硝酸钾的提纯方法;
(2)根据配制溶液时造成误差原因分析;
(3)根据20℃时KNO3的溶解度,求出此时的溶质的质量分数作一比较;
(4)根据溶质质量分数的计算方法进行分析.
(2)根据配制溶液时造成误差原因分析;
(3)根据20℃时KNO3的溶解度,求出此时的溶质的质量分数作一比较;
(4)根据溶质质量分数的计算方法进行分析.
解答:解:(1)由KNO3和NaCl的溶解度曲线知,20℃时KNO3的溶解度为31.6g;50℃时KNO3的溶解度为85.5g,所以将85.5g固体药品溶于100g水中,由于含有杂质,所以形成的是不饱和溶液;因为硝酸钾的溶解度是随温度的升高而增大,并且受温度影响较大,提纯的方法可以用降温结晶法.故答案为:20℃时KNO3的溶解度为31.6g;不饱和;降温结晶;
(2)所配溶液中KNO3溶质质量分数偏小的原因要从两个方面考虑:溶质少或溶剂多,KNO3固体仍然不纯,溶质少;溶解前,烧杯中有少量水,溶剂多;用量筒量取水时俯视读数,量取到的液体水偏少,即配得的质量分数会偏大;装瓶时,有少量溶液洒出导致溶液的质量减小,而溶质质量分数不会改变,所以①②符合;故答案为:①②;
(3)20℃时KNO3溶液溶质的质量分数为
×100%≈24%,所以不会出现31.6%的KNO3溶液,故填:不行;
(4)设需要加入溶质质量为X则:
═20%,解得X=25g,设需要蒸发水的质量为Y则:
═20%,解得Y=100g.
故答案为:(1)20℃时KNO3的溶解度为31.6 g(其他合理即可);不饱和;降温结晶(冷却热的饱和溶液);(2)①②;(3)不行;(4)25;100
(2)所配溶液中KNO3溶质质量分数偏小的原因要从两个方面考虑:溶质少或溶剂多,KNO3固体仍然不纯,溶质少;溶解前,烧杯中有少量水,溶剂多;用量筒量取水时俯视读数,量取到的液体水偏少,即配得的质量分数会偏大;装瓶时,有少量溶液洒出导致溶液的质量减小,而溶质质量分数不会改变,所以①②符合;故答案为:①②;
(3)20℃时KNO3溶液溶质的质量分数为
| 31.6g |
| 100g+31.6g |
(4)设需要加入溶质质量为X则:
| 200g×10%+X |
| 200g+X |
| 200g×10% |
| 200g-Y |
故答案为:(1)20℃时KNO3的溶解度为31.6 g(其他合理即可);不饱和;降温结晶(冷却热的饱和溶液);(2)①②;(3)不行;(4)25;100
点评:解答本题容易出错的地方是溶质质量分数偏小的原因:要从两个方面分析:溶质称少了,溶剂量多了.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案
相关题目