题目内容
【题目】铁粉与硫酸铜溶液反应,除了有红色固体生成外,还有气体产生.为确定气体的成分,进行下列实验探究.
(1)猜想与假设:产生的气体可能是 . 猜想的依据是 . 查阅资料:
①SO2使酸性高锰酸钾溶液褪色.
②O2+4KI+4HCl=2I2+4KCl+2H2O,淀粉遇I2变蓝.
③H2、CO等气体能将氧化铜还原成铜.
④浓硫酸有吸水性
(2)实验验证: ①将气体通入酸性高锰酸钾溶液中,无现象,则该气体中SO2(填“有”或“无”).
②用如图所示实验检验氢气和氧气: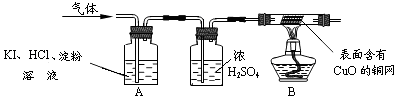
B中观察到 , 证明该气体是H2 .
(3)实验反思:①若没有浓H2SO4 , 对实验结论的影响是 . ②由上述实验可知,硫酸铜溶液中的溶质是(填化学式).
③写出产生气体的化学方程式 .
【答案】
(1)SO2、O2、H2中的一种或几种;质量守恒定律
(2)无;黑色固体逐渐变红,且管壁有水珠
(3)不能确认使黑色固体逐渐变红的气体是氢气;H2SO4、CuSO4;H2SO4+Fe=FeSO4+H2↑
【解析】解:猜想与假设:依据质量守恒定律可知气体可能是SO2、O2、H2中的一种或几种;实验验证:①将气体通入酸性高锰酸钾溶液中,无现象,则该气体中无SO2;②加热条件下,氧化铜和氢气反应生成铜和水,所以B中观察到黑色固体逐渐变红,且管壁有水珠,证明该气体是H2;实验反思:①浓硫酸有吸水性,所以若没有浓H2SO4对实验结论的影响是不能确认使黑色固体逐渐变红的气体是氢气;②由上述实验可知,硫酸铜溶液中的溶质是:H2SO4、CuSO4;③产生气体的反应是铁和硫酸反应生成硫酸亚铁和氢气,化学方程式为:H2SO4+Fe=FeSO4+H2↑.
所以答案是:SO2、O2、H2中的一种或几种,质量守恒定律;实验验证:(1)无(2)黑色固体逐渐变红,且管壁有水珠;实验反思:(3)不能确认使黑色固体逐渐变红的气体是氢气;(4)H2SO4、CuSO4;(5)H2SO4+Fe=FeSO4+H2↑.
【考点精析】认真审题,首先需要了解书写化学方程式、文字表达式、电离方程式(注意:a、配平 b、条件 c、箭号).

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案