题目内容
某兴趣小组在实验室中制取CO2气体后,对废液进行后续探究,他向一定质量的废液中逐滴加入溶质质量分数为10%的Na2CO3溶液.实验过程中加入Na2CO3溶液质量与产生沉淀或气体的质量关系如图1所示;加入Na2CO3溶液的质量与溶液的PH变化关系如图2所示,下列说法正确的是( )

| A、图1中b点的值为106 |
| B、由图1知该废液中肯定有过量的盐酸 |
| C、图1中c点,溶液中的溶质肯定有NaCl,可能有CaCl2 |
| D、图1中0→a段反应过程中溶液的pH变化情况可用图2中d→h段曲线表示 |
考点:盐的化学性质,溶液的酸碱性与pH值的关系,根据化学反应方程式的计算
专题:常见的盐 化学肥料
分析:根据加入的碳酸钠先与盐酸反应,把盐酸消耗完了,才开始与氯化钙反应,开始生成沉淀,最后到达最高点说明已经反应完了进行解答.
解答:解:
A、根据题意可知碳酸钠先与盐酸反应,再与氯化钙反应,由图示可知碳酸钠与盐酸反应生成气体2.2g,碳酸钠与氯化钙反应,生成沉淀5.0g.设生成2.2g气体所需的Na2CO3的质量为y,生成沉淀5.0g所需Na2CO3的质量为z.则
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 44
y 2.2g
=
y=5.3g;
Na2CO3溶液的质量=
53g,所以图1中b点的值为53,故错误;
B、加入的碳酸钠先与盐酸反应,把盐酸消耗完了,才开始与氯化钙反应,开始生成沉淀,所以可以判断图中oa段表示生成的气体质量,说明盐酸过量,故对;
C、c点表示碳酸钠恰好完全反应,溶液中只含有NaCl一种溶质,故错误;
D、图1中0→a段反应过程是碳酸钠溶液和盐酸反应,开始盐酸有剩余,溶液呈酸性,当盐酸反应后,溶液中溶质有氯化钠和氯化钙,溶液呈中性,所以图1中0→a段反应过程中溶液的pH变化情况可用图2中d→h段曲线表示,故对.
答案:BD
A、根据题意可知碳酸钠先与盐酸反应,再与氯化钙反应,由图示可知碳酸钠与盐酸反应生成气体2.2g,碳酸钠与氯化钙反应,生成沉淀5.0g.设生成2.2g气体所需的Na2CO3的质量为y,生成沉淀5.0g所需Na2CO3的质量为z.则
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 44
y 2.2g
| 106 |
| 44 |
| y |
| 2.2g |
y=5.3g;
Na2CO3溶液的质量=
| 5.3g |
| 10% |
B、加入的碳酸钠先与盐酸反应,把盐酸消耗完了,才开始与氯化钙反应,开始生成沉淀,所以可以判断图中oa段表示生成的气体质量,说明盐酸过量,故对;
C、c点表示碳酸钠恰好完全反应,溶液中只含有NaCl一种溶质,故错误;
D、图1中0→a段反应过程是碳酸钠溶液和盐酸反应,开始盐酸有剩余,溶液呈酸性,当盐酸反应后,溶液中溶质有氯化钠和氯化钙,溶液呈中性,所以图1中0→a段反应过程中溶液的pH变化情况可用图2中d→h段曲线表示,故对.
答案:BD
点评:解答本题关键要知道只有把盐酸反应完了,才能与氯化钙反应产生沉淀,因为如果碳酸钠与氯化钙先反应生成了碳酸钙沉淀,也会被剩余的盐酸溶解掉,将不会看到沉淀.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
下列反应中,既不是化合反应又不是分解反应的是( )
A、CH4+O2
| ||
B、HgO
| ||
C、Fe+O2
| ||
D、H2+O2
|
下面是4位同学对“化学与健康”这一话题发表的见解,其中正确的是( ) 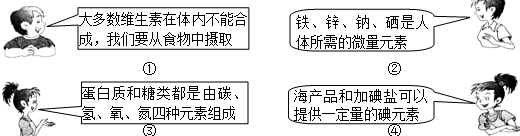

| A、①③ | B、①② | C、只有③ | D、①④ |
下列实验操作中正确的是( )
A、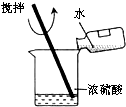 稀释浓硫酸 |
B、 滴加液体 |
C、 称量氢氧化钠固体 |
D、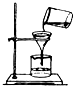 过滤 |
下列物质的用途中,主要应用其化学性质的是( )
| A、红磷燃烧用作烟雾弹 |
| B、用干冰进行人工降雨 |
| C、用铜丝做导线 |
| D、氮气用作粮食瓜果填充气 |
下列结构示意图中,表示阳离子的是( )
A、 |
B、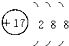 |
C、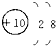 |
D、 |
能使澄清石灰水变浑浊的气体是( )
| A、二氧化碳 | B、氮气 |
| C、水蒸气 | D、氧气 |
下列各组物质中,均属纯净物的是( )
| A、新鲜空气 臭氧 |
| B、天然气 水银 |
| C、冰水 干冰 |
| D、医用酒精 碘盐 |