题目内容
【题目】甲、乙、丙、丁、戊分别是HNO3、Na2SO4、Ba(NO3)2、NaOH、BaCl2五种溶液中的一种.现利用X溶液加以鉴别,它们之间存在如图所示的转化关系: 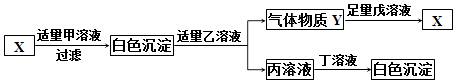
请填写下列空白:
(1)甲、乙、丙、丁、戊之间能发生个反应.
(2)写出甲、丁、戊所代表的溶液中溶质的化学式:甲 , 丁 , 戊 .
(3)写出X与足量乙溶液反应的化学方程式: .
【答案】
(1)3
(2)BaCl2;Na2SO4;NaOH
(3)Na2CO3+2HNO3=2NaNO3+H2O+CO2↑
【解析】解:如果X是碳酸钠,则甲是氯化钡,碳酸钠和氯化钡反应生成氯化钠和碳酸钡白色沉淀,如果乙是稀硝酸,则稀硝酸和碳酸钡反应生成硝酸钡、水和二氧化碳,则Y是二氧化碳,二氧化碳和氢氧化钠反应生成碳酸钠和水,则戊是氢氧化钠,丙是硝酸钡,如果丁是硫酸钠,则硝酸钡和硫酸钠反应生成硝酸钠和白色沉淀硫酸钡,由分析可知,甲是氯化钡,乙是稀硝酸,丙是硝酸钡,丁是硫酸钠,X是碳酸钠,化学式分别是BaCl2、HNO3、Ba(NO3)2、Na2SO4、Na2CO3 . 故:(1)因为氯化钡溶液与硫酸钠反应、硝酸钡与硫酸钠反应、硝酸与碳酸钠反应,故甲、乙、丙、丁、戊之间能发生 3个反应.(2)甲、丁、戊所代表的溶液中溶质的化学式分别为:甲 BaCl2 , 丁 Na2SO4 , 戊 NaOH.(3)X与足量乙溶液反应的化学方程式为:Na2CO3+2HNO3=2NaNO3+H2O+CO2↑.
所以答案是:(1)3;(2)甲:BaCl2 , 丁:Na2SO4 , 戊:NaOH.(3)Na2CO3+2HNO3=2NaNO3+H2O+CO2↑.
【考点精析】关于本题考查的书写化学方程式、文字表达式、电离方程式,需要了解注意:a、配平 b、条件 c、箭号才能得出正确答案.

【题目】以饱和NaCl溶液和饱和NH4HCO3溶液为原料制备NaHCO3的原理为:NaCl+NH4HCO3═NaHCO3↓+NH4Cl.(已知NH4HCO3在40℃受热易分解) 回答下列问题:
(1)该反应中的甲种物质溶解度曲线如图所示: 
①35℃时,比较A、B溶解度的大小;AB.(填“<”或“>”).
②图中表示NaHCO3溶解度曲线的是 . (填“A”或“B”).
(2)为探究NaHCO3析出的最佳条件,完成了如图几组实验:
实验序号 | 反应温度/℃ | 反应时间/min | NaHCO3产率/% |
a | 30 | 60 | 86.8 |
b | 30 | 120 | X |
c | 35 | 60 | 89.4 |
d | 35 | 120 | 92.5 |
e | 40 | 60 | 85.3 |
f | 40 | 120 | 85.6 |
①实验c和d的目的是 .
②表格中X的数值可能为 .
A、85.8 B、86.8 C、92.1 D、93.1
③在相同反应时间,40℃时NaHCO3的产率比35℃时低的原因是 .