题目内容
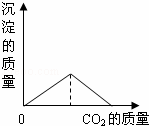
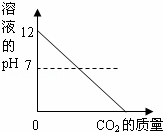
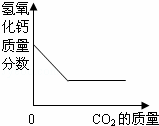
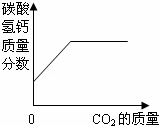
向澄清石灰水中通入过量的CO2,发生如下反应:Ca(OH)2+CO2=CaCO3↓+H2O,CO2+CaCO3+H2O=Ca(HCO3)2,Ca(HCO3)2易溶于水.下列图示正确的是( )
|
| A. |
| B. |
| C. |
| D. |
|
| A、根据二氧化碳与氢氧化钙反应生成碳酸钙,所以沉淀质量增加,二氧化碳过量后沉淀又被溶解,即减少; B、碱性减弱但不至于减成酸性溶液来分析; C、根据反应情况分析; D、在一开始没有碳酸氢钙来考虑本题. | |
| 解答: | 解:A、一开始二氧化碳与氢氧化钙反应生成碳酸钙即第一个反应,沉淀质量增加,二氧化碳过量后又发生了第二个反应所以沉淀减少,最后为零,故A正确; B、由二氧化碳与氢氧化钙反应生成碳酸钙可知溶液碱性减弱,PH值减小,但通过第二个反应可知生成物为碳酸氢钙仍然是显碱性,故PH值不应减小到零.故B错误; C、由于二氧化碳过量,氢氧化钙的质量最后应该为零,故C错误; D、由于反应一开始并没有碳酸氢钙生成,所以曲线应该从零点开始. 故选A. |

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目