题目内容
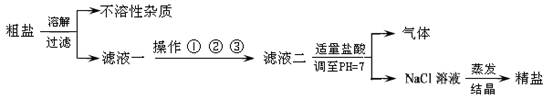
(4分)从海水得到的粗盐,往往含有可溶性杂质(主要有)和不溶性杂质(泥沙等),必须进行分离和提纯后才能用于工业生产和人们的日常生活.粗盐提纯的部分流程如下:
其中,滤液一至滤液二之间需进行三步操作:
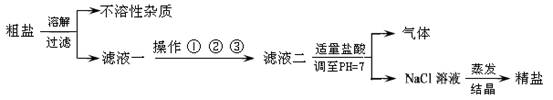
操作一: 加入过量的碳酸钠,除去滤液中的Ca2+
操作二: 加入过量的X,除去滤液中的Mg2+
操作三: 加入过量的氯化钡,除去滤液中的SO42-
请回答:
(1)操作中的物质X为 ,正确的操作顺序为 (填序号),为最终获得精盐,操作①、②和③后还需增加的操作是 ;
(2)滤液二中加入适量稀盐酸的目的是 .
【答案】
(1)氢氧化钠溶液;③①②或②③①;过滤;(2)除掉过量的氢氧化钠和过量的碳酸钠
【解析】(1)除去镁离子是利用将镁离子沉淀出来除去,所以用氢氧根离子即可,又因为不能引入新的杂质最后得到的是氯化钠,所以阳离子是钠离子;所以X是氢氧化钠;加入碳酸钠的目的有两个:一是除去过量的氯化钡,而是除去滤液中的Ca2+;所以碳酸钠必须放在氯化钡的后面,氢氧化钠可以在前面或者在后面;①、②和③产生了三种沉淀,所以将沉淀与滤液分离的方法是通过过滤的方法;
(2)由于加入的碳酸钠和氢氧化钠都是过量的,所以加入盐酸是为的与过量的碳酸钠和氢氧化钠反应

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
 (2012?绍兴)21世纪是海洋开发与利用的世纪.
(2012?绍兴)21世纪是海洋开发与利用的世纪.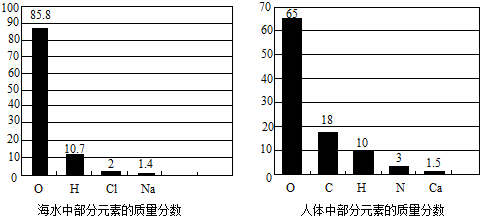

 阅读以下短文,回答下列问题.
阅读以下短文,回答下列问题.