题目内容
【题目】图像能直观体现化学中的各种变化关系,加深对化学知识的理解。下列图像不能正确反映对应关系的是
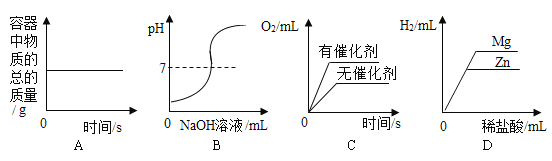
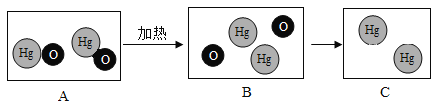
A.图A是在密闭的容器中加热汞得到氧化汞
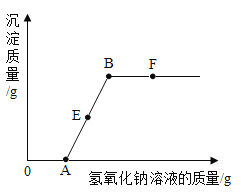
B.图B是向一定量的稀盐酸中滴加氢氧化钠溶液
C.图C是两份等质量、等溶质的质量分数的过氧化氢溶液分别制取氧气
D.图D是向等质量的Zn和Mg中分别滴加等溶质质量分数的稀盐酸
【答案】C
【解析】
A、在密闭容器里加热汞得到氧化汞,根据质量守恒定律,容器中的物质总质量保持不变,故A正确;
B、向一定量的稀盐酸中滴加氢氧化钠溶液,盐酸为酸性,pH小于7,氢氧化钠为碱性,pH大于7,所以溶液pH由小于7逐渐变为大于7,故B正确;
C、两份等质量、等溶质的质量分数的过氧化氢溶液分别在有无催化剂的条件下制取氧气,催化剂只能加快反应速率,最后产生的氧气总量应该相同,故C错误;
D、等质量的金属镁和锌中分别滴入溶质质量分数相等的稀盐酸至过量,开始时金属过量,稀盐酸完全反应,生成氢气的质量相同;当向等质量的镁和锌中加入溶质质量分数相同的稀盐酸至过量,则镁和锌全部参加反应,![]()
![]()
通过反应的化学方程式以及金属与酸反应生成氢气的质量关系可以看出,镁生成的氢气大于锌,故D正确。
故选C。

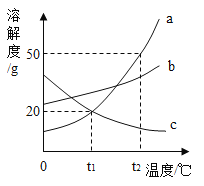
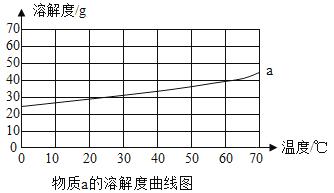
【题目】a、b是常见的两种固体物质,根据图表的信息回答下列问题:
物质b的溶解度表
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
b的溶解度/g | 14 | 20 | 30 | 45 | 65 | 85 | 110 |
(1)60℃时,物质a的溶解度是______g。
(2)20℃时,将20g物质b加入到50g水中,充分溶解后得到溶液的质量为________g。
(3)将50℃时a、b两物质的饱和溶液分别降温至20℃,所得溶液的溶质质量分数大小关系为a______b(填“>”、“=”或者“<”)。
(4)下列说法正确的组合是_______(填字母序号)。
①所有物质的溶解度都随温度的升高面增大
②30℃时,物质的溶解度a小于b
③物质b中含有少量a时,可以采用降温结晶的方法提纯b
④40℃时,分别将物质a、b的饱和溶液降温至10℃,析出物质的质量b大于a
A ①④
B ①③
C ②③
D ②④
【题目】有位化学教师在实验室取用生石灰时,发现装满生石灰的塑料试剂瓶已经膨胀破裂(如图)。某化学兴趣小组的同学在该老师的指导下,对该生石灰样品开展了以下探究活动。
(提出问题)生石灰样品的成分是什么?
(作出猜想)生石灰样品的成分可能是CaO、Ca(OH)2和CaCO3中的一种或几种。
(实验探究)小华同学设计如下实验进行探究。
实验 | 实验操作 | 实验现象 | 实验结论 |
① | 取样品于烧杯中,加水溶解,用手触摸烧杯壁。 | 烧杯壁发热 | _____ |
② | 将①中液体过滤,取少量滤液于试管中,向其中滴入_____。 | 溶液变红 | 有Ca(OH)2 |
③ | 取②中的少许滤渣于试管中,向其中滴加少量稀盐酸。 | _____ | 无CaCO3 |
(交流讨论)
(1)同学们经过讨论,发现通过实验②不能得出样品中一定含有Ca(OH)2,理由是_______。
(2)小红同学提出实验③结论也不正确。他改进实验③,并通过实验证明生石灰样品中含有碳酸钙,他改进实验③的操作内容是_________。
(3)通过小组合作,最后得出样品中肯定含有CaO和CaCO3,可能含有Ca(OH)2。请写出生成CaCO3的化学方程式_________。
(反思应用)
(1)生石灰要________保存。
(2)设计和分析实验时,要充分考虑反应物的量和生成物等因素对实验结论的干扰。
(3)要确定样品中是否含有氢氧化钙,还需要学习更多化学知识才能解决。