题目内容
【题目】 硝酸钾是初中化学重要的一种盐,请按要求填写下列有关空格:
(1)硝酸钾_____(填“属于”或“不属于”)复合肥。
(2)硝酸钾是制备黑火药的原料,其反应原理是:2KNO3+S+3C![]() K2S+3CO2↑+X↑.此反应生成物X的名称是_____。
K2S+3CO2↑+X↑.此反应生成物X的名称是_____。
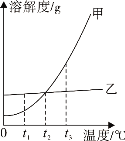
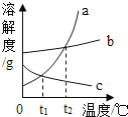
(3)如图为硝酸钾和另外两种物质的溶解度曲线示意图,能表示KNO3的溶解度曲线的是_____(填“a”、“b”或“c”);将t2℃时饱和的KNO3溶液降温至t1℃,溶液中溶质的质量分数的变化是_____(填“变大”、“变小”或“不变”)。
(4)酸与碱发生中和反应可生成盐,则发生中和反应生成硝酸钾的化学方程式为_____。
【答案】属于 氮气 a 变小 KOH+HNO3=KNO3+H2O
【解析】
根据题目信息和溶解度曲线可知:a、b两种固体物质的溶解度,都是随温度升高而增大,而c的溶解度随温度的升高而减少;
(1)硝酸钾属于复合肥;
(2)根据质量守恒定律得出;
(3)如图为硝酸钾和另外两种物质的溶解度曲线示意图,能表示KNO3的溶解度曲线的是a;将t2℃时饱和的KNO3溶液降温至t1℃,溶液中溶质的质量分数的变小;
(4)酸与碱发生中和反应可生成盐,氢氧化钾和硝酸反应生成硝酸钾和水。
(1)硝酸钾属于复合肥,因为它的营养元素是氮元素和钾元素;故答案为:属于;
(2)硝酸钾是制备黑火药的原料,其反应原理是:2KNO3+S+3C![]() K2S+3CO2↑+X↑.根据质量守恒定律,此反应生成物X的名称是氮气;故答案为:氮气;
K2S+3CO2↑+X↑.根据质量守恒定律,此反应生成物X的名称是氮气;故答案为:氮气;
(3)如图为硝酸钾和另外两种物质的溶解度曲线示意图,能表示KNO3的溶解度曲线的是a;将t2℃时饱和的KNO3溶液降温至t1℃,溶液中溶质的质量分数的变小;故答案为:a;变小;
(4)酸与碱发生中和反应可生成盐,氢氧化钾和硝酸反应生成硝酸钾和水;故答案为:KOH+HNO3=KNO3+H2O;

【题目】在密闭容器中有甲、乙、丙、丁四种物质、在一定条件下反应,测得反应前及反应过程中的t1和t2两个时刻各物质的质量如下表所示,其中 a、b、c、d 分别表示相应物质的质量。下列数据不正确的是( )
时间 | 甲 | 乙 | 丙 | 丁 |
反应前 | 70g | 14g | 6g | 10g |
t1 时刻 | a | 11g | c | d |
t2时刻 | 42g | b | 40g | 10g |
A. a=56gB. b=8gC. c=17gD. d=10g