题目内容
(3分)将15.8 g高锰酸钾放入试管中加热制取氧气,充分反应至不再产生气体为止。
计算:剩余固体物质的总质量是多少克?(已知:2KMnO4 K2MnO4+MnO2+O2↑)
K2MnO4+MnO2+O2↑)
计算:剩余固体物质的总质量是多少克?(已知:2KMnO4
 K2MnO4+MnO2+O2↑)
K2MnO4+MnO2+O2↑)14.2 g
试题分析:要计算高锰酸钾反应后剩余固体的质量,只要计算出反应生成的氧气的质量,便可以以此计算出剩余固体的质量。
解:设:生成氧气的质量为x
2KMnO4
 K2MnO4 + MnO2 + O2↑
K2MnO4 + MnO2 + O2↑ 2×158 32
15.8 g x
(2×158):32="15.8" g:x
X="1.6" g
剩余固体的质量是:15.8 g ﹣1.6 g="14.2" g
答:剩余固体的质量是14.2 g
点评:根据化学方程式计算,要注意解题的步骤,设、写、找、列、解、答。

练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
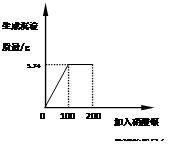
 2N2+3H2O。若反应后得到28 gN2,理论上消耗氨气多少克?
2N2+3H2O。若反应后得到28 gN2,理论上消耗氨气多少克? Ca(OH)2+C2H2↑。若要制取13 g乙炔气体,需要碳化钙的质量是多少克?
Ca(OH)2+C2H2↑。若要制取13 g乙炔气体,需要碳化钙的质量是多少克?