题目内容
【题目】请用化学方程式表示下列原理。
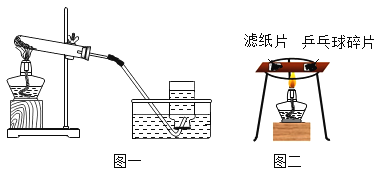
(1)用锡焊接钢板时,焊接处要滴加稀盐酸除锈,其原理方程式:_________; 然后必须用水把残留的酸液冲洗干净的原因是_____(文字表述)。
(2)检验氢氧化钠是否变质的化学反应方程式_____。
【答案】Fe2O3+6HCl=2FeCl3+3H2O 残余的稀盐酸会腐蚀钢板和铁继续反应,生产氯化亚铁和氢气; ![]()
【解析】
(1)稀盐酸和铁锈的主要成分氧化铁反应生成氯化铁和水化学方程式为Fe2O3+6HCl=2FeCl3+3H2O,残余的稀盐酸要冲洗干净否则会腐蚀钢板和铁继续反应,生产氯化亚铁和氢气,故填:Fe2O3+6HCl=2FeCl3+3H2O;残余的稀盐酸会腐蚀钢板和铁继续反应,生产氯化亚铁和氢气;
(2)氢氧化钠和二氧化碳反应生成碳酸钠和水,造成氢氧化钠变质,碳酸钠可以和氯化钙生成碳酸钙沉淀和氯化钠,加入氯化钙生成白色沉淀说明氢氧化钠变质化学方程式为;
![]() 故填:
故填:![]() ;
;

练习册系列答案
相关题目
【题目】20℃时,将不同质量的NaCl晶体分别加入100g水中,充分溶解后所得溶液质量与加入NaCl晶体质量的对应关系如表:
组别 物质质量 | A | B | C | D | E |
NaCl晶体质量/g | 5 | 15 | 20 | 30 | 40 |
所得溶液质量/g | 105 | 115 | x | 130 | 136 |
请回答下列问题:
(1)A组的溶液为____(填“饱和”或“不饱和”)溶液。
(2)C组X的值为____。
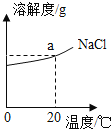
(3)如图为NaCl的溶解度曲线图,图上a点纵坐标的值为____。
(4)某学校实验室配置1000g10%的NaCl溶液,需要浓度为15%的NaC溶液____ mL。(已知15%NaCl溶液的密度为1.2g/cm3。计算结果保留一位小数)