题目内容
(2011?静安区二模)在研究酸和碱化学性质时,某小组同学想证明:稀硫酸与氢氧化钠溶液混合后,虽然仍为无色溶液,但确实发生了化学反应.请与他们一起完成实验方案的设计、实施和评价.
[演示实验]向装有一定量氢氧化钠溶液的试管中滴加几滴酚酞溶液,再滴加稀硫酸,并不断振荡溶液,若观察到
[交流评价]请你评价上述两组由实验现象获得的结论是否正确,并说明理由.
方案①:
方案②:
[拓展实验]取一定量的稀硫酸,逐滴匀速滴加氢氧化钠溶液,测得反应过程中pH变化(
20℃)如图所示:从0→t1时,溶液的酸碱性变化情况是
[演示实验]向装有一定量氢氧化钠溶液的试管中滴加几滴酚酞溶液,再滴加稀硫酸,并不断振荡溶液,若观察到
红色消失
红色消失
(实验现象),则证明氢氧化钠溶液与稀硫酸发生了化学反应,反应的化学方程式为H2SO4+2NaOH=Na2SO4+2H2O;
H2SO4+2NaOH=Na2SO4+2H2O;
.[提出问题]是否可以用其他实验方法证明稀硫酸与氢氧化钠溶液能发生反应呢?| 学生探究 | 实验过程 | 实验现象 | 结论 |
| 方案① |  |
加入氢氧化钠溶液后,温度明显上升. | 测量温度变化可以证明稀硫酸与氢氧化钠溶液能发生反应 |
| 方案② |  |
出现白色沉淀 | 用氯化钡溶液可以证明稀硫酸与氢氧化钠溶液能发生反应 |

方案①:
正确,中和反应放热,如果温度升高,则可证明稀硫酸与氢氧化钠溶液能发生反应
正确,中和反应放热,如果温度升高,则可证明稀硫酸与氢氧化钠溶液能发生反应
.方案②:
错误,因为氢氧化钠与硫酸反应与否都不影响硫酸钡白色沉淀的生成
错误,因为氢氧化钠与硫酸反应与否都不影响硫酸钡白色沉淀的生成
.[拓展实验]取一定量的稀硫酸,逐滴匀速滴加氢氧化钠溶液,测得反应过程中pH变化(
20℃)如图所示:从0→t1时,溶液的酸碱性变化情况是
溶液酸性不断减弱,t1时变为中性
溶液酸性不断减弱,t1时变为中性
.由图示分析,稀硫酸与氢氧化钠溶液发生反应的依据是溶液PH增大,t1时PH=7
溶液PH增大,t1时PH=7
.当加入氢氧化钠溶液到t2时,所得溶液中的溶质为(写化学式)Na2SO4和NaOH
Na2SO4和NaOH
.分析:【演示实验】根据碱遇酚酞变红,利用酸碱反应使碱减少,颜色变化来分析
【交流评价】依据中和反应放热的知识判断①,依据氢氧化钠、硫酸、氯化钡之间的反应对结论进行分析即可;
【拓展实验】根据图中的PH变化和物质之间的变化来分析溶液酸碱性的变化;
【交流评价】依据中和反应放热的知识判断①,依据氢氧化钠、硫酸、氯化钡之间的反应对结论进行分析即可;
【拓展实验】根据图中的PH变化和物质之间的变化来分析溶液酸碱性的变化;
解答:解:【演示实验】因酚酞滴入到氢氧化钠溶液中变为红色,当向碱性溶液中加稀硫酸时,发生H2SO4+2NaOH═Na2SO4+2H2O反应使碱减少至消失,则红色逐渐变浅至消失,即可利用溶液颜色的变化来判断发生反应;H2SO4+2NaOH═Na2SO4+2H2O;
【交流评价】①依据中和反应发生时会放出热量的知识可知:氢氧化钠与硫酸混合后温度升高则证明两者发生了中和反应,故设计方案正确;
②因为硫酸钠与氯化钡,硫酸与氯化钡反应都会生成硫酸钡的白色沉淀,所以出现白色沉淀不能证明氢氧化钠与稀硫酸发生了反应;
【拓展实验】①由图可知pH在不断变大,t1时PH为7,即溶液的酸性不断减弱,t1时变为中性,判断发生酸和碱发生反应的依据是根据图中PH变化,随着碱的滴加溶液的酸性减弱pH变大,直至恰好反应pH=7,溶液呈中性,在t2时pH大于7溶液呈碱性,此时溶液中氢氧化钠过量,所以溶液中的溶质是硫酸钠和氢氧化钠.
故答案为:【演示实验】红色消失;H2SO4+2NaOH═Na2SO4+2H2O;
【交流评价】①正确,中和反应放热,如果温度升高,则可证明稀硫酸与氢氧化钠溶液能发生反应②错误,因为氢氧化钠与硫酸反应与否都不影响硫酸钡白色沉淀的生成;
【拓展实验】溶液酸性不断减弱,t1时变为中性;溶液PH增大,t1时PH=7;Na2SO4和NaOH;
【交流评价】①依据中和反应发生时会放出热量的知识可知:氢氧化钠与硫酸混合后温度升高则证明两者发生了中和反应,故设计方案正确;
②因为硫酸钠与氯化钡,硫酸与氯化钡反应都会生成硫酸钡的白色沉淀,所以出现白色沉淀不能证明氢氧化钠与稀硫酸发生了反应;
【拓展实验】①由图可知pH在不断变大,t1时PH为7,即溶液的酸性不断减弱,t1时变为中性,判断发生酸和碱发生反应的依据是根据图中PH变化,随着碱的滴加溶液的酸性减弱pH变大,直至恰好反应pH=7,溶液呈中性,在t2时pH大于7溶液呈碱性,此时溶液中氢氧化钠过量,所以溶液中的溶质是硫酸钠和氢氧化钠.
故答案为:【演示实验】红色消失;H2SO4+2NaOH═Na2SO4+2H2O;
【交流评价】①正确,中和反应放热,如果温度升高,则可证明稀硫酸与氢氧化钠溶液能发生反应②错误,因为氢氧化钠与硫酸反应与否都不影响硫酸钡白色沉淀的生成;
【拓展实验】溶液酸性不断减弱,t1时变为中性;溶液PH增大,t1时PH=7;Na2SO4和NaOH;
点评:本题属于实验探究习题,在探究碱的性质时学生应利用学过的碱的性质并结合习题中的信息来分析解答.

练习册系列答案
相关题目
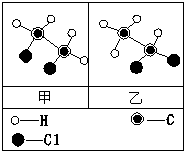 (2011?静安区二模)甲(化学式为C2H4Cl2)和乙的分子结构示意图如图所示.资料表明:甲、乙的结构不同,性质也有一定差异.小明根据甲和乙的分子结构和性质得出如下结论,其中错误的是
(2011?静安区二模)甲(化学式为C2H4Cl2)和乙的分子结构示意图如图所示.资料表明:甲、乙的结构不同,性质也有一定差异.小明根据甲和乙的分子结构和性质得出如下结论,其中错误的是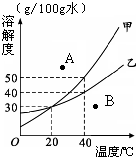 (2011?静安区二模)如图是某实验小组绘制的甲乙两种固体物质的溶解度曲线图.请你根据图示回答问题:
(2011?静安区二模)如图是某实验小组绘制的甲乙两种固体物质的溶解度曲线图.请你根据图示回答问题: