题目内容
某学校课外活动小组用3g少量CO2的CO的混合气体做CO还原CuO实验,实验装詈如下图,实验数据记录如下表,、假定每个反应都完全进行:试计算该实验参加反应的CO的质量分数.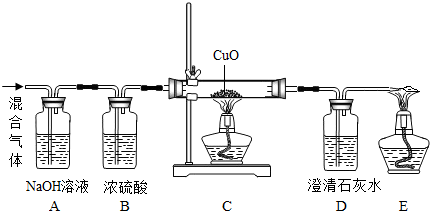
实验记录表
| 实验装置代号 | A | B | D |
| 实验前总质量(g) | 100 | 100 | 100 |
| 实验后总质量(g) | 100.5 | 100.5 | 102.2 |
分析:根据物质的性质以及题干提供的信息尽心分析,氢氧化钠能吸收二氧化碳,浓硫酸具有吸水性,能用来吸收水分,一氧化碳能与氧化铜反应生成黄铜和二氧化碳,二氧化碳能与氢氧化钙反应.
解答:解:A装置增加的质量为100.5g-100g=0.5g,故混合气体中一氧化碳的质量为3g-0.5g=2.5g,生成二氧化碳的质量为102.2g-100g=2.2g,设参加反应的一氧化碳的质量为x
CuO+CO
Cu+CO2
28 44
x 2.2g
=
x=1.4g
该实验参加反应的CO的质量分数为:
×100%=56%
答:该实验参加反应的CO的质量分数为56%.
CuO+CO
| ||
28 44
x 2.2g
| 28 |
| x |
| 44 |
| 2.2g |
x=1.4g
该实验参加反应的CO的质量分数为:
| 1.4g |
| 2.5g |
答:该实验参加反应的CO的质量分数为56%.
点评:本题考查了一氧化碳还原氧化铜的实验以及根据化学方程式的计算,完成此题,可以依据已有的知识结合反应的化学方程式进行.

练习册系列答案
相关题目
 (1)某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用质量分数为2%的氢氧化钠溶液进行中和,如右图所示.请你计算废水中盐酸的溶质质量分数.(写出具体的计算过程)
(1)某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用质量分数为2%的氢氧化钠溶液进行中和,如右图所示.请你计算废水中盐酸的溶质质量分数.(写出具体的计算过程)在测定时,有同学发现在反应过程中,溶液有温度的变化,于是他们进一步进行了探究.在一定体积的10%的氢氧化钠溶液中滴加10%的盐酸,反应中溶液的温度与加入盐酸的体积变化如下:
| 加入盐酸体积V/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 测得溶液温度t/℃ | 15.2 | 19.6 | 22.0 | 26.0 | 28.2 | 26.7 | 25.7 | 24.7 | 23.7 | 22.9 |

(3)根据上述曲线变化讨论溶液温度变化的原因.
①加入盐酸的量在2~10mL之间时:
②加入盐酸的量在10~20mL之间时:
(4)若某同学提出“将氢氧化钠固体直接与10%盐酸反应,以探究中和反应是否放热”,此提议是否合理?为什么?答:
某学校课外活动小组用3g少量CO2的CO的混合气体做CO还原CuO实验,实验装詈如下图,实验数据记录如下表,、假定每个反应都完全进行:试计算该实验参加反应的CO的质量分数.
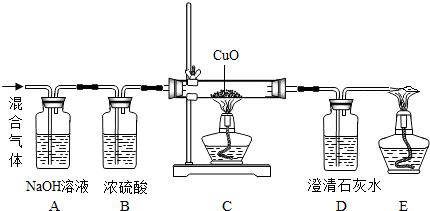
实验记录表
| 实验装置代号 | A | B | D |
| 实验前总质量(g) | 100 | 100 | 100 |
| 实验后总质量(g) | 100.5 | 100.5 | 102.2 |
某学校课外活动小组用3g少量CO2的CO的混合气体做CO还原CuO实验,实验装詈如下图,实验数据记录如下表,、假定每个反应都完全进行:试计算该实验参加反应的CO的质量分数.

实验记录表

实验记录表
| 实验装置代号 | A | B | D |
| 实验前总质量(g) | 100 | 100 | 100 |
| 实验后总质量(g) | 100.5 | 100.5 | 102.2 |
 (2005?海门市)某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用2%的氢氧化钠溶液进行中和,当溶液pH=7时,用去氢氧化钠溶液20g.计算废水中盐酸的溶质质量分数.
(2005?海门市)某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用2%的氢氧化钠溶液进行中和,当溶液pH=7时,用去氢氧化钠溶液20g.计算废水中盐酸的溶质质量分数.