题目内容
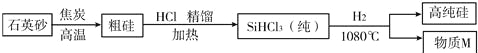
【题目】实验室常利用以下装置完成气体制备及性质实验.请回答:

(1)指出编号仪器的名称:① .
(2)以上装置有一处明显的错误,请加以改正 .利用改正后的装置继续完成后面的实验.
(3)欲使用高锰酸钾制取氧气,应选择的发生装置是 (填字母),反应原理用化学方程式表示 为 ;为防止高锰酸钾粉末进入导管,应采取的措施是 .
(4)将CO 2和CO的混合气体通过F装置(液体药品均足量),实验开始时关闭活塞b,打开活塞a,广口瓶中观察到的现象是 ,此时从导管c逸出的气体主要是CO.一段时间后,再关闭活塞a,打开活塞b,将分液漏斗中的稀盐酸滴入广口瓶中,此时逸出的气体主要是CO 2,反应原理用化学方程式表示为 ,欲收集该气体,应选择E装置,验满的 方法
【答案】(1)酒精灯;
(2)A中的导管应该进入橡皮塞少许;
(3)A; 2KMnO 4 ![]() K 2MnO 4+MnO 2+O 2↑;在试管口放一团棉花;
K 2MnO 4+MnO 2+O 2↑;在试管口放一团棉花;
(4)澄清的石灰水变浑浊;CaCO 3+2HCl=CaCl 2+H 2O+CO 2↑;将一根燃着的木条平放在集气瓶口,木条熄灭,证明满了
【解析】
试题分析:(1) 仪器①的名称为酒精灯;(2)有题中图示可知,A装置中导管伸入试管过长,应该进入橡胶塞少许;(3)使用高锰酸钾制取氧气,因为固体加热制取气体,故应选择固体加热型发生装置A,反应原理用化学方程式表示为2KMnO 4 ![]() K 2MnO 4+MnO 2+O 2↑,为防止高锰酸钾粉末进入导管,应采取的措施是在试管口放一团棉花;(4)将CO 2和CO的混合气体通过F装置(液体药品均足量),实验开始时关闭活塞b,打开活塞a,广口瓶中观察到的现象是澄清的石灰水变浑浊; 此时从导管c逸出的气体主要是CO.一段时间后,再关闭活塞a,打开活塞b,将分液漏斗中的稀盐酸滴入广口瓶中,此时逸出的气体主要是CO 2,反应原理用化学方程式表示为CaCO 3+2HCl=CaCl 2+H 2O+CO 2↑,收集该气体,应选择E装置,验满的方法利用二氧化碳不燃烧也不支持燃烧的性质,具体为将一根燃着的木条平放在集气瓶口,木条熄灭,证明满了。
K 2MnO 4+MnO 2+O 2↑,为防止高锰酸钾粉末进入导管,应采取的措施是在试管口放一团棉花;(4)将CO 2和CO的混合气体通过F装置(液体药品均足量),实验开始时关闭活塞b,打开活塞a,广口瓶中观察到的现象是澄清的石灰水变浑浊; 此时从导管c逸出的气体主要是CO.一段时间后,再关闭活塞a,打开活塞b,将分液漏斗中的稀盐酸滴入广口瓶中,此时逸出的气体主要是CO 2,反应原理用化学方程式表示为CaCO 3+2HCl=CaCl 2+H 2O+CO 2↑,收集该气体,应选择E装置,验满的方法利用二氧化碳不燃烧也不支持燃烧的性质,具体为将一根燃着的木条平放在集气瓶口,木条熄灭,证明满了。

【题目】下表中各组物质的鉴别方法正确的是( )
选项 | 需要鉴别的物质 | 鉴别方法 |
A | 稀盐酸、氯化钠溶液、氢氧化钠溶液 | 滴加石蕊溶液 |
B | 硫酸钾、硫酸钡、碳酸钙 | 加入足量的水 |
C | 氮气、氧气、二氧化碳 | 用燃着的木条区分 |
D | 铁粉、木炭粉、氧化铜粉末 | 加入足量的稀硫酸 |
A.A B.B C.C D.D