题目内容
氢氧化钠俗名苛性钠,是一种重要的化工原料.下列研究从其结构、制备方法、性质以及变化规律等角度进行,请根据要求回答相应问题。
Ⅰ.结构:
NaOH含有钠元素,钠在元素周期表中处于第三周期的 (填“开头”、“中间”或“结尾”)。
NaOH属于碱,碱在溶液中都可以电离出相同的离子,该离子是 (填离子符号)。
Ⅱ.制备:
实验室用纯碱制备烧碱的化学反应方程式为 。Ⅲ.性质及变化:
(1)氢氧化钠固体曝露在空气中容易 ,因此它与生石灰一起用作某些气体的干燥剂
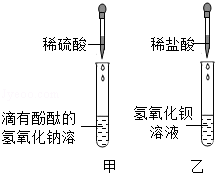
(2)如右图所示,NaOH溶液可与稀酸反应的方程式为 。
该反应没有明显的现象,为了说明该反应确实能够发生,下列哪种物质肯定无法帮助你达到目的 。
a.镁条 b.酚酞 c.CuSO4 d.Ba(NO3)2
Ⅳ.保存:
张老师整理药品时,意外发现实验桌上有瓶敞口放置的NaOH固体,他让同学们对这瓶NaOH固体进行探究
【提出猜想】
猜想I:没有变质
猜想Ⅱ:部分变质为Na2CO3,依据是 (用方程式表示);猜想Ⅲ:全部变质
【实验设计、现象和推断】
| 实验步骤 | 实验现象 |
| ①取少量白色固体于试管中,加水振荡后,至全部溶解 | 无色溶液 |
| ②向试管的溶液中滴加适量物质X的溶液 | 现象A |
| ③再向试管中滴加几滴酚酞试液. | 现象B |
(1)若现象A为有气泡产生,则加入的X溶液是 ,说明猜想 可排除。
(2)若X是Ca(OH)2溶液,现象A有白色沉淀,现象B为无色变红色,该实验 (填“能”或“不能”)说明猜想Ⅱ成立。
(3)若X是CaCl2溶液,则猜想Ⅱ成立的实验现象是 。
(4)定量研究:根据上述实验,可通过测定 ,
再通过计算得到氢氧化钠的变质情况。

Ⅰ开头;OH- Ⅱ Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
Ⅲ(1)吸水潮解;(2)2NaOH+H2SO4=Na2SO4+2H2O;d;Ⅳ2NaOH+CO2=Na2CO3+H2O;
(1)稀盐酸;I (2)不能;(3)现象A有白色沉淀产生,现象B溶液变成红色;
(4)产生气体的质量或产生白色沉淀的质量。
解析试题分析:Ⅰ.结构:钠在元素周期表中处于第三周期的开头;
碱在溶液中都可以电离出相同的氢氧根离子;
Ⅱ.制备:
实验室用纯碱和氢氧化钙反应制备烧碱,反应的化学反应方程式为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
Ⅲ.性质及变化:
(1)氢氧化钠固体曝露在空气中容易吸水潮解,因此能用作某些气体的干燥剂;
(2)NaOH溶液可与稀酸反应的方程式为2NaOH+H2SO4=Na2SO4+2H2O;
a、镁条可以和稀硫酸反应产生气体,因此加入镁条不产生气泡,则说明反应;
b、酚酞遇碱变红,因此滴加酚酞,若不变红,则说明反应;
c、硫酸铜能和氢氧化钠反应生成蓝色絮状沉淀,因此滴加硫酸铜溶液,若无蓝色絮状沉淀,则说明反应;
d、因硝酸钡和硫酸、硫酸钡反应都产生沉淀,因此无法用来判断是否反应,故选d;
Ⅳ.保存:因氢氧化钠和二氧化碳反应生成碳酸钠和水而变质;
(1)盐酸和碳酸钠反应生成氯化钠、水和二氧化碳气体,若滴加稀盐酸产生气泡,说明已变质,可排除I;
(2)氢氧化钙和碳酸钠反应会生成碳酸钙沉淀和氢氧化钠,要检验氢氧化钠,就不能引入氢氧根离子;
(3)滴加氯化钙溶液有白色沉淀产生,说明溶液中有碳酸钠,说明已变质;氯化钙、氯化钠溶液显中性,滴加酚酞溶液变成红色,说明溶液中有氢氧化钠;
(4)可通过测定产生气体的质量或产生白色沉淀的质量,再通过计算可得到氢氧化钠的变质情况。
考点:考查碱的化学性质;常见碱的特性和用途

某化学兴趣小组回收利用废旧干电池。
实验1 回收填料中的二氧化锰和氯化铵
查阅资料:废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水。兴趣小组的同学们设计回收物质的流程如图1所示。
(1)操作1和操作2的名称都是___________,该操作中玻璃棒的作用是__________。
(2)灼烧滤渣l的目的是____________________________。
实验2利用外壳回收物锌制取氢气及相关探究
(3)用锌和稀硫酸制取氢气。己知氢气密度比空气小且难溶于水,提供装置如图2。
①应选择:发生装置为____(填编号),排空气法收集装置为____(填编号)。
②若用排水法收集并测定气体的体积,气体从装置B导管口接____(填“a”或“b”) 进;选用仪器F测量排出水的体积,仪器F名称是___________________。
(4)探究影响锌与稀硫酸反应快慢的因素。反应过程中,用前10min内收集的氢气体积比较反应的快慢。控制其他条件相同,进行下表四组实验,获得数据如下表。
| 验实号编 | 试 剂 | 前 10min 内产生的氢气体积(mL) | |
| 不同纯度的锌 | 不同体积和浓度的稀硫酸 | | |
| a | 纯锌 | 30mL 30% | 564.3 |
| b | 含杂质的锌 | 30mL 30% | 634.7 |
| c | 纯锌 | 30mL 20% | 449.3 |
| d | 纯锌 | 40mL 30% | 602.8 |
①比较实验a和实验b,可以得到的结论是__ __。
②为了研究硫酸浓度对反应快慢的影响,需比较实验___ _和实验____(填编号).
③控制其他条件相同,需控制的条件是__ __(列举一种条件即可)。
请你参与某学习小组的探究活动,并回答相关问题.
某化学兴趣小组的同学把氢氧化钠的片状固体放在表面皿中,离开实验室.三天后进行观察.
发现问题:三天后片状固体变成白色粉末状固体了
提出问题:“白色粉末固体物质是什么?”
建立假设:
设计实验:请你来完成以下实验,把相关内容填写在表格中.
| 实验方法及操作 | 可能观察到的现象 | 实验结论 |
| | | |
反思与应用:我们学过的哪些物质还具有这样的性质? ,应如何保存这些物质 .
碳酸钙在高温下煅烧一段时间后,得到白色固体(CaCO3 CaO+CO2↑),为了确定白色固体的成分,对其可能的组成进行探究,请你完成下表.
CaO+CO2↑),为了确定白色固体的成分,对其可能的组成进行探究,请你完成下表.
| 假设(猜想) | 验证方法及操作 | 可能看到的现象 | 结 论 |
| | | | |
膨松剂是一种食品添加剂.它在面包制作过程中发生反应产生气体,使面包变得松软.膨松剂反应产生气体的量作为检验膨松剂品质的一项重要指标.已知某膨松剂含碳酸氢钠、碳酸氢铵(NH4HCO3)中的一种或两种,化学兴趣小组对该膨松剂进行如下探究: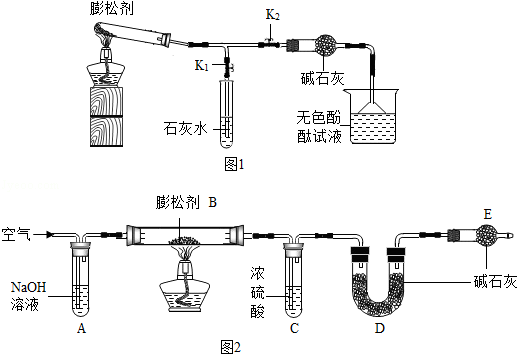
【查阅资料】
①2NaHCO3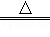 Na2CO3+H2O+CO2↑; NH4HCO3
Na2CO3+H2O+CO2↑; NH4HCO3 NH3↑+H2O+CO2↑.
NH3↑+H2O+CO2↑.
②浓硫酸常用于吸收水蒸气和氨气.
③碱石灰是固体氢氧化钠和氧化钙的混合物,不与氨气反应.
实验I:探究膨松剂的成分
按如图1所示连接好装置(夹持仪器略去,下同).
(1)实验记录
| 实验操作 | 主要实验现象 | 实验结论及解释 | |
| ① | 检查装置的气密性. 向装置中加入药品. 关闭K1,打开K2 | | 装置的气密性良好. |
| ② | 点燃酒精灯. 打开K1,关闭K2. | 试管中白色固体减少, | 有二氧化碳生成,A中反应的化学方程式为 . |
| ③ | 打开K2,关闭K1. | 无色酚酞试液变红 | 有氨气生成. |
| ④ | 继续充分加热. | 试管中仍有固体 | |
(2)得出结论:该膨松剂的成分为 .
实验II:探究膨松剂受热产生气体的量
(1)测定二氧化碳的质量:如图2所示装置(气密性良好,各装置中的试剂为足量).
将8g膨松剂装入装置B中,通过测定实验前后装置 (填字母序号)的质量,其质量差即为样品产生的二氧化碳气体的质量.加热前,先对已连接好的装置A、B和C通一段时间的空气,再连接上装置D、E;加热过程中,装置C的作用是 ;停止加热后,应继续通入空气一段时间,以保证产生的气体被装置充分吸收.
(2)测定氨气的质量:调整图2装置的连接顺序为 .另取8g膨松剂装入装置B中,通过测定实验前后装置C的质量,其质量差即为样品产生的氨气的质量.
【解释与结论】同学们进一步对实验结果进行分析后,认为该膨松剂质量良好.
【反思与评价】实验II中,若没有装置E,造成测定结果可能会 (填“偏大”、“不变”或“偏小”).
在化学实验室里,酒精是最常用到的一种燃料,其化学式是C2H6O。小明为了证明酒精中含有碳、氢元素,设计并完成如下实验方案。请你帮他完成下面的实验报告。
【实验目的】:证明酒精中含有碳、氢元素。
【实验用品】:酒精灯、火柴、洁净干燥的小烧杯、澄清石灰水
【实验过程及结论】
| 实验步骤 | 实验现象 | 实验结论 |
| 步骤一:点燃酒精灯,将洁净干燥的小烧杯罩在火焰上方 | 烧杯内壁 有 生成; | 证明酒精中含有 元素 |
| 步骤二:迅速取下烧杯,并加入少量 ,振荡; | | 证明酒精中含有碳元素 |