题目内容
【题目】(3分)工业废水中含有硫酸亚铁、硫酸铜和污泥。某同学设计了利用废水制备硫酸亚铁晶体(FeSO4·7H2O)并回收铜的实验方案,流程如下:
已知:硫酸亚铁晶体受热易分解。
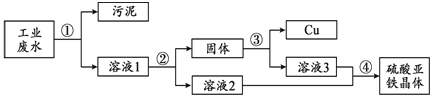
回答下列问题:
(1)步骤②中需加入的物质及目的是 。
(2)步骤③中发生反应的化学方程式为 。
(3)步骤④的操作是蒸发浓缩、降温结晶、 。
【答案】(1)过量的铁粉,把硫酸铜全部转化为铜 (2)Fe + H2SO4 = FeSO4 +H2↑ (3)过滤
【解析】
试题分析:(1)因为主要目的是将硫酸铜转化为硫酸亚铁,故步骤②中需加入的物质:过量的铁粉,目的是:把硫酸铜全部转化为铜
(2)由于步骤②中加入的是过量的铁粉,故所得的固体中含有铜和铁,故步骤③就是将固体中的铁反应掉,所以其中发生反应的化学方程式为:Fe + H2SO4 = FeSO4 +H2↑
(3)步骤④最终得到硫酸亚铁晶体,故操作是蒸发浓缩、降温结晶、过滤

练习册系列答案
相关题目