题目内容
某厂生产的纯碱包装袋上标有Na2CO3 90%字样(杂质为NaCl).为判断该纯碱是否合格,取12g样品放入烧杯中,加入100g稀盐酸,恰好完全反应.反应后所得溶液质量为107.6g(产生的气体全部逸出,且知:Na2CO3+2HCl=2NaCl+CO2↑+H2O).试计算:(写出计算过程)
(1)反应生成二氧化碳的质量;
(2)所用稀盐酸中溶质的质量分数;
(3)判断该纯碱产品是否合格.
解:(1)反应生成二氧化碳的质量=12g+100g-107.6g=4.4g;
(2)设100g稀盐酸中溶质的质量为x,样品中Na2CO3 的质量为y.
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 73 44
y x 4.4g
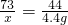
x=7.3g

y=10.6g
所用稀盐酸中溶质的质量分数= ×100%=7.3%.
×100%=7.3%.
(3)样品中碳酸钠的质量分数= ×100%=88.3%,
×100%=88.3%,
因为88.3%<90%,所以该纯碱产品不合格.
答:(1)反应生成二氧化碳的质量为4.4g;
(2)所用稀盐酸中溶质的质量分数7.3%;
(3)该纯碱产品不合格.
分析:根据样品的质量与稀盐酸的质量和去掉反应后溶液的质量所得的质量是生成二氧化碳的质量.由二氧化碳的质量根据碳酸钠与稀盐酸反应的化学方程式可以计算出样品中碳酸钠的质量、稀盐酸中溶质的质量.进而计算出所用稀盐酸中溶质的质量分数和样品中碳酸钠的质量分数进行解答.
点评:本题主要考查有关含杂质物质的化学方程式计算和溶质质量分数的计算,难度较大.
(2)设100g稀盐酸中溶质的质量为x,样品中Na2CO3 的质量为y.
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 73 44
y x 4.4g
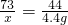
x=7.3g

y=10.6g
所用稀盐酸中溶质的质量分数=
 ×100%=7.3%.
×100%=7.3%.(3)样品中碳酸钠的质量分数=
 ×100%=88.3%,
×100%=88.3%,因为88.3%<90%,所以该纯碱产品不合格.
答:(1)反应生成二氧化碳的质量为4.4g;
(2)所用稀盐酸中溶质的质量分数7.3%;
(3)该纯碱产品不合格.
分析:根据样品的质量与稀盐酸的质量和去掉反应后溶液的质量所得的质量是生成二氧化碳的质量.由二氧化碳的质量根据碳酸钠与稀盐酸反应的化学方程式可以计算出样品中碳酸钠的质量、稀盐酸中溶质的质量.进而计算出所用稀盐酸中溶质的质量分数和样品中碳酸钠的质量分数进行解答.
点评:本题主要考查有关含杂质物质的化学方程式计算和溶质质量分数的计算,难度较大.

练习册系列答案
相关题目