题目内容
(6分)下图为元素周期表的部分内容,结合表中内容回答问题。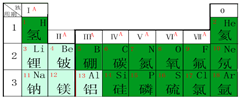
(1)12号元素镁的元素符号为 。
(2)氟元素的原子结构示意图为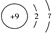 , 从原子结构分析,下列元素化学性质与氟相似的是 (填序号)。
, 从原子结构分析,下列元素化学性质与氟相似的是 (填序号)。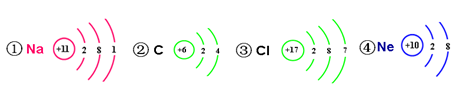
(3)某种钠原子的相对原子质量为23,该钠原子核内的中子数为 。
(4)小红取一瓶氢气和一瓶氯气进行实验。首先将氢气和氯气按右图所示装置放置,抽掉玻璃片,过一会观察到 ,产生这一现象的原因是 。 然后点燃一段镁条,靠近集气瓶,氢气和氯气在光照条件下发生爆炸,生成稳定的化合物氯化氢,该反应的化学方程式为 。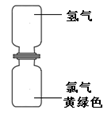
(1)Mg ; (2)③ ; (3)12
(4)上下都变为黄绿色,但颜色较原Cl2的颜色浅;分子在不断运动;
H2 +Cl2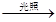 2HCl
2HCl
解析试题分析:(1)根据元素周期表可知,12号元素镁的元素符号为Mg;
(2)最外层电子数相同的原子,化学性质相似,根据氟元素的原子结构示意图可知,氟元素的原子最外层有7个电子,故选③;
(3)在原子中,相对原子质量=质子数+中子数,根据题意,某种钠原子的相对原子质量为23,而钠原子的质子数为11,所以钠原子核内的中子数为12;
(4)分子在不断的运动,当抽掉玻璃片时,氯气分子和氢气分子由于不断运动,相互混合,所以上下都变为黄绿色,但颜色较原Cl2的颜色要浅;根据题意,氢气和氯气在光照条件下发生爆炸,生成稳定的化合物氯化氢,故反应的化学方程式为H2+Cl2 2HCl。
2HCl。
考点:元素周期表的特点及其应用,原子的定义与构成,核外电子在化学反应中的作用,利用分子与原子的性质分析和解决问题,书写化学方程式
点评:熟练掌握最外层电子数决定元素化学性质,相对原子质量=质子数+中子数,以及分子的性质等知识是解答本题关健。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案下图为元素周期表的一部分,请认真阅读后,回答下列问题
| 1 H 1.008 | 2 He 4.003 | ||||||
| 3 Li 6.941 | 4 Be 9.012 | 5 B 10.81 | 6 C 12.01 | 7 N 14.01 | 8 O 16.00 | 9 F 19.00 | 10 Ne 20.18 |
| 11 Na 22.99 | 12 Mg 24.31 | 13 Al 26.98 | 14 Si 28.09 | 15 P 30.97 | 16 S 32.06 | 17 Cl 35.45 | 18 Ar 39.95 |
(2)原子序数为8的元素是______,位于元素周期表中的第______周期,第______族;周期数等于______数.

