题目内容
下列变化过程中,不包含缓慢氧化的是
- A.钢铁生锈
- B.酒和醋的酿造
- C.蔗糖的溶解
- D.动植物的呼吸
C
分析:根据缓慢氧化的定义和特点判断,缓慢氧化是指氧化反应进行得很慢,甚至不易被察觉,特点是放热、不发光.
解答:A、锈蚀是金属与氧气、水等发生缓慢氧化反应造成的,则包含缓慢氧化,故错误.
B、酒和醋的酿造是植物籽粒中的糖与氧发生氧化反应的过程,符合缓慢氧化的特点,所以错误.
C、蔗糖的溶解是扩散过程,属于物理变化,所以正确.
D、动植物的呼吸是体内有机物在酶的作用下与氧发生氧化反应的过程,符合缓慢氧化的特点,所以错误.
故选C.
点评:燃烧、自燃、爆炸、缓慢氧化是初中化学上的几个易混的基本概念,掌握它们的概念,明确它们的本质区别是解决该类题目的关键.
分析:根据缓慢氧化的定义和特点判断,缓慢氧化是指氧化反应进行得很慢,甚至不易被察觉,特点是放热、不发光.
解答:A、锈蚀是金属与氧气、水等发生缓慢氧化反应造成的,则包含缓慢氧化,故错误.
B、酒和醋的酿造是植物籽粒中的糖与氧发生氧化反应的过程,符合缓慢氧化的特点,所以错误.
C、蔗糖的溶解是扩散过程,属于物理变化,所以正确.
D、动植物的呼吸是体内有机物在酶的作用下与氧发生氧化反应的过程,符合缓慢氧化的特点,所以错误.
故选C.
点评:燃烧、自燃、爆炸、缓慢氧化是初中化学上的几个易混的基本概念,掌握它们的概念,明确它们的本质区别是解决该类题目的关键.

练习册系列答案
 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
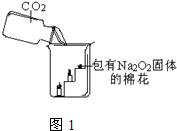 30、过氧化钠(Na2O2)是一种淡黄色固体.在一次科技活动中,某化学兴趣小组的同学将包有Na2O2固体的棉花放入了如图1的实验中,发现了高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭;同时也惊奇地发现棉花燃烧了起来.
30、过氧化钠(Na2O2)是一种淡黄色固体.在一次科技活动中,某化学兴趣小组的同学将包有Na2O2固体的棉花放入了如图1的实验中,发现了高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭;同时也惊奇地发现棉花燃烧了起来.

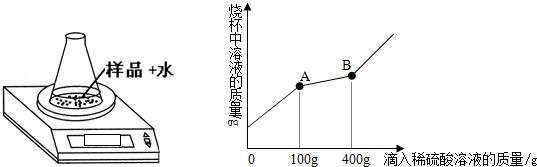
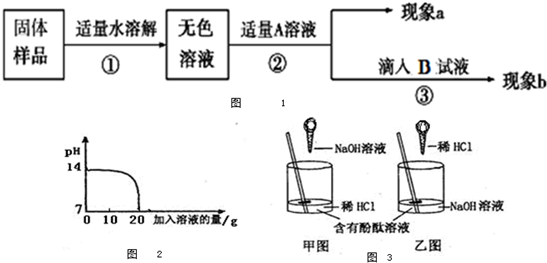

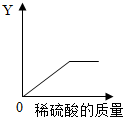

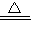 Na2CO3+CO2↑+H2O;③NaHCO3+HCl═NaCl+CO2↑+H2O;④少量的NaHCO3与Ca(OH)2反应:NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O
Na2CO3+CO2↑+H2O;③NaHCO3+HCl═NaCl+CO2↑+H2O;④少量的NaHCO3与Ca(OH)2反应:NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O