题目内容
【题目】把干燥、纯净的氯酸钾和二氧化锰的混合物31.5g装入大试管中,加热制取氧气。待完全反应后,将试管冷却、称量,得到21.9g固体物质。
(1)制得氧气的质量是_____克,判断的依据是_____:
(2)计算31.5g混合物中氯酸钾的质量_____。(写出计算过程)
(3)21.9g固体物质中含有的物质是MnO2和_______(写化学式)。通过溶解、过滤、_____、干燥等操作可以得到纯净的二氧化锰。
【答案】9.6 根据质量守恒定律,反应前后质量相等 24.5g KCl 洗涤
【解析】
(1)根据质量守恒定律可得,反应前后质量相等,固体减少的质量为生成的氧气的质量,生成的氧气的质量为:31.5g-21.9g=9.6g。
(2)设混合物中KClO3的质量为x。
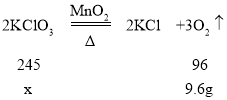
![]()
解得:x=24.5g
31.5g混合物中氯酸钾的质量为24.5g。
(3)由于是完全反应,所以21.9g的固体是氯化钾和二氧化锰的混合物,氯化钾的化学式为:KCl;通过溶解、过滤、洗涤、干燥等操作可以得到纯净的二氧化锰。

练习册系列答案
相关题目
【题目】将乙醇和氧气置于密闭容器中引燃,测得反应前后各物质的质量如下:
物质(纯净物) | 乙醇 | 氧气 | 二氧化碳 | 水 | M |
反应前质量/g | 2.3 | 4 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 2.2 | X | Y |
表格中“X、Y”分别为_____;若要使生成物中无物质M,需要再增加氧气的质量为_____g。